
 把一块锌片和一块铜片平行地插入盛有稀硫酸溶液的烧杯中,观察到的现象是
把一块锌片和一块铜片平行地插入盛有稀硫酸溶液的烧杯中,观察到的现象是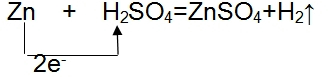 ,
,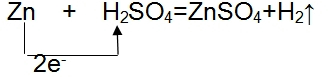 .
.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、硫酸钠和氯化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| B、Fe片插入FeCl3溶液中:Fe+Fe3+=2Fe2+ |
| C、铁和硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、碳酸钙与稀盐酸反应:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①中水的电离程度最小,③中水的电离程度最大 |
| B、将②③混合,若有pH=7,则消耗溶液的体积:②>③ |
| C、将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① |
| D、将①④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Al3+、MnO4-、OH- |
| B、Na+、Al3+Ba2+、Cl- |
| C、HCO3-、H+、Cl-、NO3- |
| D、Fe3+、Na+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 粉尘催化剂 |
| A、①②③④⑤ | B、①③⑥⑦ |
| C、④⑤⑥⑦ | D、①②③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
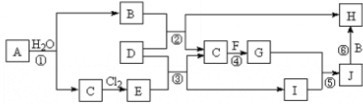
 如图表示A~D及NaOH等物质间的相互转化关系,其中A为淡黄色固体,B为短周期元素中金属性最强的单质.
如图表示A~D及NaOH等物质间的相互转化关系,其中A为淡黄色固体,B为短周期元素中金属性最强的单质.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com