
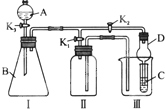
 某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.请回答下列问题:
某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.请回答下列问题:

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、碳酸钙和稀盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| B、硫酸铵溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| C、CO2通入过量氢氧化钠溶液中 CO2+2OH-═CO32-+H2O |
| D、CuO与盐酸反应:CuO+2H+═Cu2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
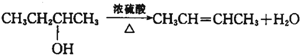
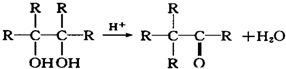

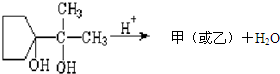
查看答案和解析>>
科目:高中化学 来源: 题型:
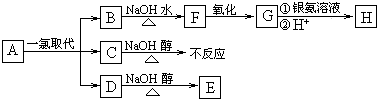
查看答案和解析>>
科目:高中化学 来源: 题型:
 某河道两旁有甲、乙两个化工厂.它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.
某河道两旁有甲、乙两个化工厂.它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.查看答案和解析>>
科目:高中化学 来源: 题型:
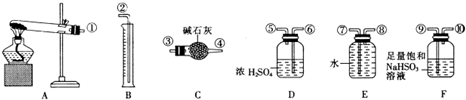
| 实验小组 | 称取硫酸铜的质量(g) | 装置c增加的质量(g) | 量筒中谁的体积折算成标准状况下气体的体积(mL) |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 3.84 | 224 |
查看答案和解析>>
科目:高中化学 来源: 题型:
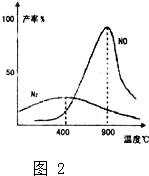
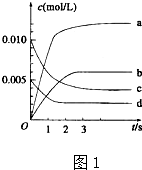 (1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.
(1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、等于0.3mol |
| B、等于0.15mol |
| C、小于0.15mol |
| D、大于0.15mol,小于0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com