
【题目】下表中给出了四个实验装置和对应的部分实验现象,其中a、b、c、d为金属电极,由此可判断四种金属的活动性顺序是( )
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气泡产生 c极无变化 | d极溶解 c极有气泡产生 | 电流计指示在导线中 电流从a极流向d极 |
A. d>a>b>cB. b>c>d>aC. a>b>c>dD. a>b>d>c
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NO,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)NaClO2中Cl元素的价态为_______。
(2)在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1 。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①在NaClO2溶液脱硝的主要反应中,参加反应的n(ClO2-):n(NO)=_________,增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐_______(填“升高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pc如下图所示:
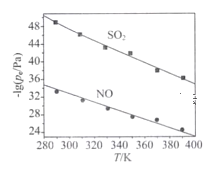 =
=
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均____(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=Q1 kJ·mol-1;CO2(g)+NaOH(aq)=NaHCO3(aq) △H=Q2 kJ·mol-1。将15.68 L(标准状况)CO2气体通入1 L 1.0 mol·L-1氢氧化钠溶液中,反应完全时能量变化为Q3 kJ则Q1、Q2、Q3之间的关系正确的是( )
A.Q3=0.3 Q1+0.4Q2B.Q3=0.7Q1C.Q3=0.7Q2D.Q3=0.4Q1+0.3Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镓(GaN)被称为第三代半导体材料,其应用已经取得了突破性的进展。
已知:(i)氮化镓性质稳定,不与水、酸反应,只在加热时溶于浓碱。
(ii)NiCl2 溶液在加热时,先转化为Ni(OH)2,后分解为NiO。
(iii)制备氮化镓的反应为:2Ga+2NH3![]() 2GaN+3H2
2GaN+3H2
某学校化学兴趣小组实验室制备氮化镓,设计实验装置如图所示:
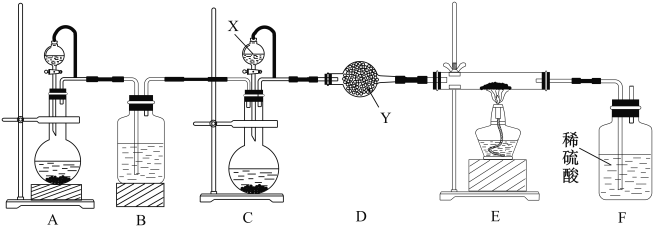
设计实验步骤如下:
①滴加几滴NiCl2 溶液润湿金属镓粉末,置于反应器内。
②先通入一段时间后的H2,再加热。
③停止通氢气,改通入氨气,继续加热一段时间。
④停止加热,继续通入氨气,直至冷却。
⑤将反应器内的固体转移到盛有盐酸的烧杯中,充分反应过滤、洗涤、干燥。
(1)仪器X中的试剂是___________,仪器Y的名称是__________________。
(2)指出该套装置中存在一处明显的错误是________________________。
(3)步骤①中选择NiCl2 溶液,不选择氧化镍的原因是____________________。
a.增大接触面积,加快化学反应速率
b使镍能均匀附着在镓粉的表面,提高催化效率
c.为了能更好形成原电池,加快反应速率
(4)步骤③中制备氮化镓,则判断该反应接近完成时观察到的现象是____________________。
(5)请写出步骤⑤中检验产品氮化镓固体洗涤干净的操作________________________。
(6)镓元素与铝同族,其性质与铝类似,请写出氮化镓溶于热NaOH溶液的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
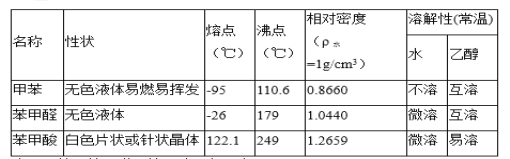
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入2mL甲苯和一定量其它试剂,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
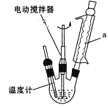
(1)装置a的名称是___,主要作用是___。三颈瓶中发生反应的化学方程式为___。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是___。
(3)反应完毕,反应混合液经过自然冷却至室温后,还应经过__、__(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的实验步骤是___(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸(相对分子质量为122)产品进行纯度测定,可称取2.5g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.0mL于锥形瓶,加入0.1mol/LKOH溶液18.0mL恰好反应,产品中苯甲酸的质量分数为__(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石、石墨烯和![]() 都是碳的同素异形体,其结构示意图如图:
都是碳的同素异形体,其结构示意图如图:

(1)金刚石属立方晶系,每个晶胞所包括的C原子个数为_____________。
(2)金刚石、石墨烯、木炭和![]() 都是由碳元素组成的单质。下列关于碳的单质的叙述正确的是_______(填序号)。
都是由碳元素组成的单质。下列关于碳的单质的叙述正确的是_______(填序号)。
A.都是黑色固体
B.碳原子的排列方式不相同
C.这四种物质都很软,可作润滑剂
D.在氧气中充分燃烧时都生成二氧化碳
E.一定条件下,木炭转化成金刚石是物理变化
(3)金刚石质硬但脆,金刚石能被砸碎的原因是_______________________________。
(4)观察计算一个![]() 分子结构中含有____________个正五边形和_________个正六边形。
分子结构中含有____________个正五边形和_________个正六边形。
(5)石墨烯是单层的石墨,它是世界上已知的最薄、最坚硬的新型材料,有良好的导电性,具有很好的应用前景。石墨烯中碳原子的杂化轨道类型为___________;碳碳键的键角是___________。
(6)碳化硅(![]() )的结构与金刚石类似,设碳化硅的密度为
)的结构与金刚石类似,设碳化硅的密度为![]() ,碳化硅晶体内碳硅键的键长为________________
,碳化硅晶体内碳硅键的键长为________________![]() (用NA表示阿伏加德罗常数的值,列表达式即可)。
(用NA表示阿伏加德罗常数的值,列表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4Br置于密闭容器中,在某温度下,发生下列反应:NH4Br(s)═NH3(g)+HBr(g),2HBr(g)Br2(g)+H2(g)。2min时,测知H2的浓度为0.5molL﹣1,HBr的浓度为4molL﹣1,若上述反应速率用v(NH3)表示,下列速率正确的是( )
A.0.5molL﹣1min﹣1B.2.5molL﹣1min﹣1 C.2molL﹣1min﹣1 D.5molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A.放电时负极反应为:Zn+2OH--2e-=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3+5OH--3e-=FeO42-+4H2O
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】系统命名法命名下列物质:有A、B、C三种烃,它们的结构简式如图所示:
![]()
A的名称是________;B的名称是________;C的名称是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com