
今有①NH3·H2O;②NaOH;③Ba(OH)2三种溶液,选择填空:
A.①>②>③ B.①<②<③ C.①=②=③ D.①>②=③
E.①=③>② F.①<②=③ G.①=②<③ H.①=②>③
(1)请写出NH3·H2O的电离方程式 。
(2)当它们的物质的量浓度相同时,其pH的关系是 。
(3)当它们pH相同时,其溶液中水的电离程度 。
(4)中和等体积、等物质的量浓度的三种碱溶液,需同物质的量浓度的盐酸溶液的体积关系为 。
科目:高中化学 来源: 题型:
2- 3 |
2- 4 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
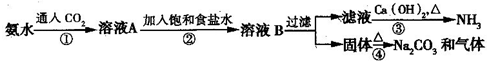
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、NH
| ||||
| 阴离子 | Cl-、CO
|
2- 4 |
| ||
| ||
2- 4 |
查看答案和解析>>
科目:高中化学 来源:江苏省盐城中学2010-2011学年高二下学期期中考试化学试题 题型:022
今有①NH3·H2O;②NaOH;③Ba(OH)2三种溶液,选择填空:
A.①>②>③
B.①<②<③
C.①=②=③
D.①>②=③
E.①=③>②
F.①<②=③
G.①=②<③
H.①=②>③
(1)请写出NH3·H2O的电离方程式________.
(2)当它们的物质的量浓度相同时,其pH的关系是________.
(3)当它们pH相同时,其溶液中水的电离程度________.
(4)中和等体积、等物质的量浓度的三种碱溶液,需同物质的量浓度的盐酸溶液的体积关系为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com