
铝热反应常用于冶炼高熔点的金属, 可简单认为是铝与某些金属氧化物在高温条件下发生的反应。某学习小组对铝热反应(以Al和Fe2O3反应为例)实验进行研究。
查阅数据得到Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下表所示:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | ┄ |
试回答下列问题:
(1)在铝热反应中金属铝表现出 性(填“氧化”或“还原”)。请判断下列金属中那一个不能由铝热反应制取 。(填序号)
①Fe ②Cr(铬) ③V(钒) ④Ca ⑤Mn
(2)某同学推测,铝热反应所得到的熔融物中应含有铁、铝两种金属。如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为 ,可观察到的实验现象是 。
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色未变血红色,即可证明熔融物中不含有Fe2O3。则
①物质甲是 (填化学式)。
②该同学的实验方案是否合理? (填“合理”或“不合理”)。
理由:
科目:高中化学 来源: 题型:
按要求填空。
(1)根据常温下氯化铵、氢氧化钡两种晶体混合搅拌反应的现象判断:
该反应△S 0,△H 0(均填“<”、“>”或“=”,下同);
(2)已知:升高温度时,反应2CH4(g)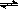 C2H4(g)+2H2(g)的平衡转化率增大,现有:
C2H4(g)+2H2(g)的平衡转化率增大,现有:
C(s)+2H2(g)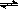 CH4(g) ΔH1;2C(s)+2H2(g)
CH4(g) ΔH1;2C(s)+2H2(g)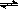 C2H4(g) ΔH2 则2ΔH1 ΔH2
C2H4(g) ΔH2 则2ΔH1 ΔH2
(3)在常温常压下测得:C(s)的燃烧热为393 kJ/mol,而1molC(s)燃烧成CO(g)放热110kJ,且6FeO(s)+O2(g)=2Fe3O4(s) ΔH=−480 kJ/mol。
请写出CO(g)还原Fe3O4(s)生成FeO(s)的热化学方程式:
;
(4)已知由气态分子断裂1mol以下共价键吸收的能量为:C-H:410kJ O=O:500 kJ C=O:750 kJ O-H:460 kJ,且常温下1mol水气化时吸收热量45kJ。写出常温下甲烷燃烧的热化学方程式:
;
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温时,一固定容积的容器内发生如下反应:2NH3 (g)  N2 (g)+3H2 (g),达平衡后,再向容器内通入一定量的NH3(g),重新达到平衡后,与第一次平衡时相比,NH3的体积分数( )
N2 (g)+3H2 (g),达平衡后,再向容器内通入一定量的NH3(g),重新达到平衡后,与第一次平衡时相比,NH3的体积分数( )
A.不变 B.增大 C.减小 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
海带中含碘元素,有人设计如下步骤来提取碘:①加入6%H2O2溶液 ②将海带烧成
灰,向灰中加入蒸馏水 ③加入CCl4振荡 ④过滤 ⑤用分液漏斗分液 ⑥加热煮沸
1~2分钟,合理的操作顺序为( )
A.②一⑥一④一①一③一⑤ B.②一①一⑥一③一④一⑤
C.②一①一③一⑥一⑤一④ D.②一③一①一⑥一⑤一④
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.反应②通入的过量Y是CO2气体
D.图中所示的转化反应①②都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是
A. 2Na + 2H2O ==2NaOH + H2↑ B. CH4 + 2O2==CO2 + 2H2O
C. KClO3==2KCl + 3O2↑ D. CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
分类法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
①根据氧化物的组成元素将氧化物分成酸性氧化物、碱性氧化物等
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否有丁达尔现象将分散系分为溶液、胶体和浊液
④根据水溶液是否能够导电将化合物分为电解质和非电解质
A.② B. ①③ C.②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
A.1∶2 B.1∶4 C.3∶4 D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式表达正确的是
A.SO2通入溴水中:SO2+2H2O+Br2===2H++SO42-+2HBr
B.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:
Ba2++2OH-+2H++SO ===BaSO4↓+2H2O
===BaSO4↓+2H2O
C.漂白粉溶液在空气中失效:ClO-+CO2+H2O===HClO+HCO3-
D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+===Fe3++3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com