
 3NaCl+NaClO4;NaClO4
3NaCl+NaClO4;NaClO4  NaCl+2O2↑
NaCl+2O2↑ 3NaCl+NaClO4,稳定性NaClO4>NaClO,在反应中NaClO4
3NaCl+NaClO4,稳定性NaClO4>NaClO,在反应中NaClO4  NaCl+2O2↑中,稳定性NaCl>NaClO4,则稳定性NaCl>NaClO4>NaClO,故C正确;
NaCl+2O2↑中,稳定性NaCl>NaClO4,则稳定性NaCl>NaClO4>NaClO,故C正确;

科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 CuSO4+SO2↑+2H2O,其中铜元素的化合价________(填“升高”或“降低”),被________(填“氧化”或“还原”,下同),浓H2SO4作________剂;在该反应中,若消耗了0.5mol Cu,则标准状况下生成SO2的体积约为________L.
CuSO4+SO2↑+2H2O,其中铜元素的化合价________(填“升高”或“降低”),被________(填“氧化”或“还原”,下同),浓H2SO4作________剂;在该反应中,若消耗了0.5mol Cu,则标准状况下生成SO2的体积约为________L.查看答案和解析>>
科目:高中化学 来源: 题型:单选题
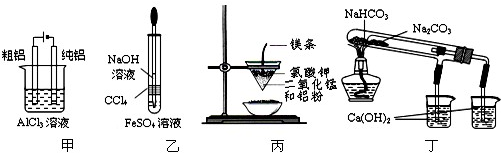
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com