
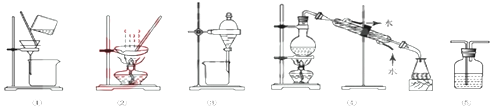
| A. | 分离Na2CO3溶液和CH3COOC2H5,选④ | B. | 粗盐提纯,选①和② | ||
| C. | 用FeC12溶液吸收C12,选⑤ | D. | 用CC14提取碘水中的碘,选③ |
分析 A.Na2CO3溶液和CH3COOC2H5分层;
B.粗盐提纯,可溶解后过滤、蒸发;
C.用FeC12溶液吸收C12,选择洗气装置;
D.用CC14提取碘水中的碘,选择萃取装置.
解答 解:A.Na2CO3溶液和CH3COOC2H5分层,应选择装置③,不能利用过滤分离,故A错误;
B.粗盐提纯,可溶解后过滤、蒸发,则选择装置①和②,故B正确;
C.用FeC12溶液吸收C12,选择洗气装置,即装置⑤,导管长进短出,故C正确;
D.用CC14提取碘水中的碘,选择萃取装置,即装置③,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
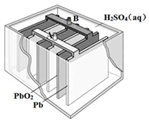 铅蓄电池是最常见的二次电池,其构造示意图如下.发生反应的化学方程式为:
铅蓄电池是最常见的二次电池,其构造示意图如下.发生反应的化学方程式为:| A. | 放电时,电解质溶液的PH值增大 | |
| B. | 放电时,电路中转移0.2mol电子时Pb电极质量减少20.7g | |
| C. | 放电时,溶液中H+向PbO2电极移动 | |
| D. | 放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-═PbSO4(s)+2H2O(l) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酶是具有催化功能的蛋白质 | |
| B. | 酶的催化作用具有选择性和专一性 | |
| C. | 高温或紫外线的照射会降低酶的活性 | |
| D. | 酶通常在强酸或强碱的条件下发挥作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、HC1、H2O | B. | HC1、H2O、O2 | C. | HC1、H2O | D. | CO2、O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 s(秒)时B的浓度为0.3 mol•L-1 | |
| B. | 4s内用物质A表示的反应速率为0.075 mol•L-1•s-1 | |
| C. | 达平衡后B的转化率为30% | |
| D. | 达平衡后若通入一定量氦气,A的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 | B. | 15 | C. | 13 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温下氮气比氧气和氯气稳定 | |
| B. | 氮、氧和氯的单质常温下为气体 | |
| C. | 氮、氧和氯分子在反应过程中释放能量 | |
| D. | 氮气、氧气和氯气的密度不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com