
短周期元素A、B. C. D最高价氧化物对应的水化物分别为X、Y、Z、W、A是短周期中原子半径最大的元素,常温下X、W均能与Y反应,A、C、D的原子序数及0.1mol/LX、Z、 W溶液的pH如图所示(已知1g2=0.3)。下列说法正确的是
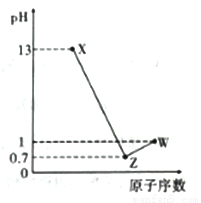
A. A的简单离子半径是这些元素中最小的
B. B与D两种元素可形成共价化合物
C. 气态氢化物的热稳定性:C>D
D. Z的盐溶液一定能促进水的电离
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源:2017届天津市河北区高三总复习质量检测 (一)化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数,下列叙述正确的是
A. 13g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.2NA
B. 71g氯气通入足量的水中,反应中转移的电子总数为NA
C. 由D和18O所组成的水11g,所含的中子数为4NA
D. 1molBrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源:2017届河南省豫南九校高三下学期质量考评七理综化学试卷(解析版) 题型:填空题
碳、氮、氧、铝都为重要的短周期元素,其单质及化合物在工农业生产生活中有重要作用。请回答下列问题:
(1)在密闭容器内(反应过程保持体积不变),使1molN2和3molH2混合发生下列反应:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol。当反应达到平衡时,N2和H2的浓度之比是_______;当升高平衡体系的温度,则混合气体的平均式量______(将“增大”“减小”或“不变”);当达到平衡时,再向容器内充入1mol N2,H2的转化率_______(填“提高”“降低”或“不变”);当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡_______移动(填“正向”“逆向”或“不”)。
2NH3(g) △H=-92.4kJ/mol。当反应达到平衡时,N2和H2的浓度之比是_______;当升高平衡体系的温度,则混合气体的平均式量______(将“增大”“减小”或“不变”);当达到平衡时,再向容器内充入1mol N2,H2的转化率_______(填“提高”“降低”或“不变”);当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡_______移动(填“正向”“逆向”或“不”)。
(2)由题干所述元素中的三种组成的某种强酸弱碱盐的化学式为________,其溶于水能_____水的电离(填“促进”或“抑制”),且使溶液的pH_______(填“升高”“降低”或“不变”),原因是_________(用离子方程式表示)。
(3)空气是硝酸工业生产的重要原料,氨催化氧化是硝酸工业的基础,氨气在铁触媒作用下只发生主反应①和副反应②:
4NH3(g)+5O2 4NO+6H2O(g) △H=-905kJ/mol ①
4NO+6H2O(g) △H=-905kJ/mol ①
4NH3(g)+3O2 2N2+6H2O(g) △H=-1268kJ/mol ②
2N2+6H2O(g) △H=-1268kJ/mol ②
①氮气与氧气反应生成NO的热化学方程式为______________________。
②在氧化炉中催化氧化时,有关物质的产率与温度的关系如图。下列说法中正确的是_____。
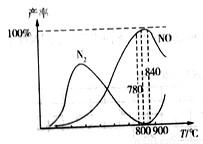
A.工业上氨催化氧化生成NO时,最佳温度应控制在780~840℃之间
B.工业上采用物料比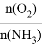 在1.7~2.0,主要是为了提高反应速率
在1.7~2.0,主要是为了提高反应速率
C.加压可提高NH3生成NO的转化率
D.由图可知,温度高于900℃时,生成N2的副反应增多,故NO产率降低
(4)M是重要的有机化工原料,其分子与H2O2含有相同的电子数,将1molM在氧气中完全燃烧,只生成1molCO2和2molH2O,则M的化学式为_______。某种燃料电池采用铂作为电极催化剂,以KOH溶液为电解质,以M为燃料,以空气为氧化剂。若该电池工作时消耗1molM,则电路中通过_____mol电子。
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:选择题
聚甲基丙烯酸甲脂的缩写代号为PMMA,俗称有机玻璃,其单体的分子式为C5H8O2。下列说法正确的是
A. 合成PMMA的单体是甲基丙烯酸和甲醇
B. 合成PMMA的单体可以发生加成反应、取代反应、缩聚反应
C. C5H8O2属于羧酸的结构共有7种
D. C5H8O2某种结构中碳原子可能都处于同一平面
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三适应性月考(六)理综化学试卷(解析版) 题型:实验题
已知SO2可以用Fe(NO3)3溶液吸收,按如图所示装置展开相关探究:取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。回答下列问题:
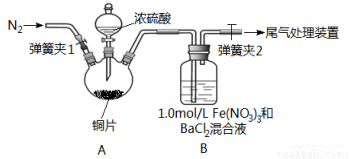
(i)装置A中用于添加浓硫酸的仪器名称为_________________。
(2)实验开始前需进行的操作是_____________________。
(3)加入浓硫酸之前先通入N2一段时间,其目的是_____________________。
(4)排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是_______;若用NaOH溶液处理尾气,则发生反应的离子方程式为_________________。
(5)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加);假设1:装置A中白雾进入装置B中参与了反应;
假设2:______________;
假设3: Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2。
(6)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0mol/LFe(NO3)3溶液的pH ②取与Fe(NO3)3溶液中c(NO3-)相同的适量Ba(NO3)2溶液滴入试管中 (3)________________ ④向试管中通入适量SO2气体 | _____________ |
(7)若假设2正确,请写出B中发生反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三下学期周练(四)理科综合化学试卷(解析版) 题型:推断题
在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
(1)写出基态E原子的价电子排布式 .
(2)B、C、D三元素第一电离能由小到大的顺序为(用元素符号表 示) ;A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与 BD化合物是等电子体,据等电子体的原理,写出BD化合物的电子式 ; A2D由液态形成晶体时密度 (填增大,不变或减小),分析主要原因(用文字叙述)
(3)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为(用元素符号表示) ;若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g/cm3(用含a、NA的符号表示).

查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三下学期周练(四)理科综合化学试卷(解析版) 题型:选择题
青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物。屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖。青蒿素分子结构如下图,下列说法中正确的是

A.青蒿素能与热的NaOH溶液反应
B.青蒿素的分子式为C15H21O5
C.青蒿素分子结构中只含有极性键
D.青蒿素能使酸性KMnO4溶液、溴的CCl4溶液分别褪色
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二下学期第一次月考化学试卷(解析版) 题型:实验题
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
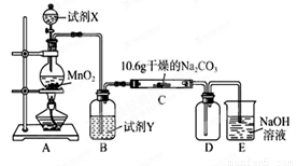
(1)写出装置A中发生反应的化学方程式:
(2)写出试剂Y的名称: 。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄
红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设。
假设一:存在两种成分: NaHCO3和
假设二:存在三种成分: NaHCO3和 、 。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 | |
步骤2: | ①若无明显现象,证明固体中不含Na2CO3 ②若溶液变浑浊,证明固体中含 Na2CO3 |
步骤3: |
(4)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二3月月考化学试卷(解析版) 题型:选择题
不能与溴水发生反应的是
①甲苯 ②邻甲基苯酚 ③亚硫酸 ④2-丁炔 ⑤AgNO3溶液 ⑥裂化汽油 ⑦1,3-丁二烯 ⑧ 环己烷 ⑨葡萄糖 ⑩乙醛
A. ①⑤ B. ①⑥⑨ C. ①⑧ D. ①②⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com