
| 25℃ | 饱和H2S溶液 | FeS | SnS | |
| pH | 3.9 | 3.0(开始沉淀 | 5.5(沉淀完全) | 1.6(沉淀完全) |
| Ksp | 6.3×10-18 | 1.0×10-25 | ||
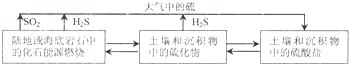
分析 (1)①2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)△H=-1036.46kj.mol-1
②S(s)+O2(g)═SO2(g)△H=-297.04kJ/mol,
由盖地定律可知,①-②×2可得2H2S(g)+O2(g)═2S(s)+2H2O(g)△H=-442.38kJ/mol,
(2)难溶电解质的溶解平衡及沉淀转化是溶解度大的物质向溶解度小的物质转化;
(3)①依据题中实验过程分析,通入硫化氢至饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液PH=2为了除去杂质离子Sn2+;
②在SnS、FeS共存的溶液中依据溶度积常数计算得到c(Fe2+);
(4)高锰酸钾溶液氧化二氧化硫为硫酸,本身被还原为锰离子,结合电荷守恒和原子守恒配平书写离子方程式,二氧化硫和碘单质在水溶液中反应生成硫酸和碘化氢,依据原子守恒配平书写化学方程式.
解答 解:(1)①2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)△H=-1036.46kj.mol-1
②S(s)+O2(g)═SO2(g)△H=-297.04kJ/mol,
由盖地定律可知,①-②×2可得:2H2S(g)+O2(g)═2S(s)+2H2O(g)△H=-442.38kJ/mol,
故答案为:2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-442.38kJ.mol-1 ;
(2)ZnS的溶解度小于铜蓝(CuS),CuSO4转变为铜蓝的离子方程式:ZnS(S)+Cu2+(aq)?Zn2+(aq)+CuS(S);
故答案为:ZnS(S)+Cu2+(aq)?Zn2+(aq)+CuS(S);
(3)①通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,除去溶液中的Sn2+离子,并防止Fe2+被氧化,已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,防止Fe2+离子生成沉淀;
故答案为:将溶液中的Sn2+转变为SnS而除去,防止Fe2+转化为FeS沉淀;
②在SnS、FeS共存的溶液中,FeS+Sn2+=SnS+Fe2+,若c(Sn2+)=1.0×10-9mol•L-1,则K=$\frac{c(F{e}^{2+})}{c(S{n}^{2+})}$=$\frac{Ksp(FeS)}{Ksp(SnS)}$=$\frac{6.3×1{0}^{-18}}{1.0×1{0}^{-25}}$,
c(Fe2+)=$\frac{6.3×1{0}^{-18}}{1.0×1{0}^{-25}}$×1.0×10-9mol•L-1=6.3×10-2mol•L-1,
故答案为:6.3×10-2mol•L-1;
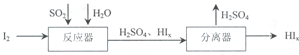
(4)若用KMnO4作脱硫剂,可使燃煤尾气中的SO2反应生成MnSO4,反应的离子方程式为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,流程分析可知二氧化硫和碘单质在水溶液中发生反应生成硫酸和碘化氢,然后在分离器中分离得到硫酸和碘化氢,反应的化学方程式为:SO2+xI2+2H2O=H2SO4+2HIx,
故答案为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,SO2+xI2+2H2O=H2SO4+2HIx.
点评 本题主要考查了热化学方程式书写、沉淀溶解平衡常数的计算,学生根据实验原理从资料中获得有效信息的能力、实验分析能力、根据化学式的计算能力等,题目难度中等.


科目:高中化学 来源: 题型:解答题
 ,请回答下列问题:
,请回答下列问题:
 .
. ;④
;④ .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
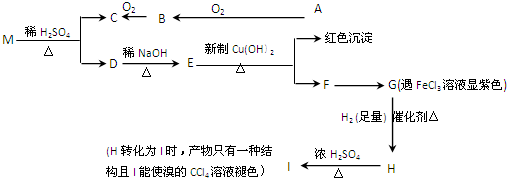
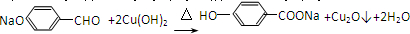 ;
; .
. .
. .
. .(任写一种)
.(任写一种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L乙醇分子所含的C-H键数为0.5NA | |
| B. | 3.2克O2和O3的混合气中含有的氧原子数目为0.2NA | |
| C. | 0.1mol•L-1的Al2(SO4)3溶液中,AL3+的数目小于0.2NA | |
| D. | 0.1molFe参加氧化还原反应,转移的电子数目一定是0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①是加成反应,反应②是取代反应 | |
| B. | 反应过程中可能会生成污染性气体 | |
| C. | C2H5OSO3H、乙醇均不能使酸性KMnO4溶液褪色 | |
| D. | 若不使用浓硫酸,乙烯仍能与水反应,但反应速率非常慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
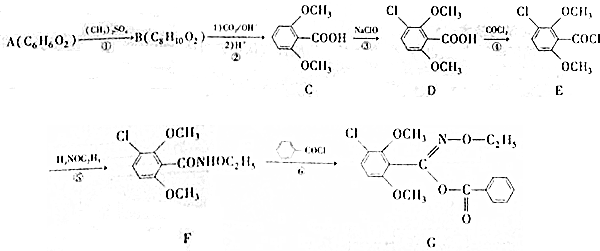
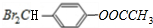
 ;⑤的反应类型为取代反应.
;⑤的反应类型为取代反应. 、
、 .
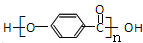
. 为原料制备
为原料制备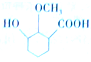 的合成路线
的合成路线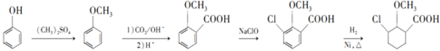
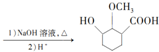
 (无机试剂可任选)
(无机试剂可任选)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知在电解槽中,每小时通过1A的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8h,制得32%的烧碱溶液(密度为1.342t/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为93.46%(保留两位小数).
已知在电解槽中,每小时通过1A的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8h,制得32%的烧碱溶液(密度为1.342t/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为93.46%(保留两位小数).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com