实验证明,纯硫酸的导电性显著强于纯水.又知液态纯酸都像水那样进行自身电离(H2O+H2O?H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数.据此回答:
(1)纯硫酸在液态时自身电离方程式是______.
(2)25℃时,液态纯硫酸的离子积常数K(H2SO4)______1×10-14(填“>”“<”或“=”)
(3)已知Ksp[Cu(OH)2]=2×10-20,要使0.2mol/L溶液中的Cu2+沉淀较为完全(使Cu2+浓度降低至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液pH为______.
解:(1)根据水的自身电离方程式,可以得出:纯硫酸在液态时自身电离方程式是2H
2SO
4,?H
3SO
4++HSO
4-,故答案为:2H
2SO
4,?H
3SO
4++HSO
4-;
(2)纯硫酸的导电性显著强于纯水,所以25℃时,液态纯硫酸的离子积常数K(H
2SO
4)>1×10
-14,故答案为:>;
(3)Cu
2+沉淀较为完全是的浓度为
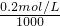
=2×10
-4mol/L,
则c(OH
-)=
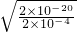
mol/L═10
-8mol/L,
则c(H
+)=
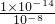
mol/L=10
-6mol/L,
所以pH=-lg(10
-6)=6,故答案为:6.
分析:(1)根据信息液态纯酸都像水那样进行自身电离:H
2O+H
2O?H
3O
++OH
-,结合电离方程式的书写方法来回答;
(2)离子积常数K越大,电离程度越强;
(3)根据K
sp=c(Cu
2+)?[c(OH
-)]
2=2×10
-20,根据Cu
2+离子的浓度计算OH
-离子的浓度,根据水的离子积常数计算氢离子浓度,并以此计算溶液pH值.
点评:本题考查学生电解质在水中的电离以及难容电解质的溶解平衡知识,注意知识的梳理和归纳是解题的关键,难度不大.

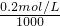 =2×10-4mol/L,
=2×10-4mol/L,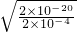 mol/L═10-8mol/L,
mol/L═10-8mol/L,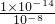 mol/L=10-6mol/L,
mol/L=10-6mol/L,

 阅读快车系列答案
阅读快车系列答案