
【题目】有机物A是一种纯净的无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
称取A物质27.0g,升温使其汽化,测其密度是相同条件下NO的3倍 | (1)A的相对分子质量为:____________ |
(2)A的核磁共振氢谱如图:
| (2)A中含有______种氢原子 |
(3)另取A27.0g与足量的NaHCO3粉末反应,生成0.3molCO2,若与足量钠反应则生成0.3mol H2 | (3)写出A中所含官能团的名称:___________ |
(4)将此27.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者依次增重16.2g和39.6g | (4)A的分子式为:________ |
(5)综上所述A的结构简式为:_______________________________ | |
【答案】904羧基,羟基C3H6O3CH3CH(OH)COOH
【解析】
(1)相同条件下,密度之比等于其摩尔质量之比,因此A的摩尔质量为30×3g·mol-1=90g·mol-1,A的相对分子质量为90;(2)根据核磁共振氢谱,有4种不同峰,因此A中含有4种不同的氢原子;(3)能与NaHCO3产生CO2,说明含有羧基,根据-COOH+HCO3-→CO2↑+H2O,求出1mol该有机物中含有羧基的物质的量为0.3×90/27mol=1mol,1mol该有机物能与金属钠产生0.3×90/27mol=1mol,根据-COOH+Na→-COONa+1/2H2,说明该有机物中含有羟基,1mol有机物含有-OH的物质的量为1mol;(4)浓硫酸吸收水,产生水的质量为16.2g,根据氢元素守恒,1mol该有机物中含有H的物质的量为![]() mol=6mol,碱石灰吸收CO2,根据碳元素守恒,1mol该有机物中含碳原子的物质的量为
mol=6mol,碱石灰吸收CO2,根据碳元素守恒,1mol该有机物中含碳原子的物质的量为![]() mol=3mol,1mol该有机物中含氧原子的物质的量为(90-6-3×12)/16mol=3mol,该有机物的分子式为C3H6O3;(5)综上所述,A的结构简式为CH3CH(OH)COOH。
mol=3mol,1mol该有机物中含氧原子的物质的量为(90-6-3×12)/16mol=3mol,该有机物的分子式为C3H6O3;(5)综上所述,A的结构简式为CH3CH(OH)COOH。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】传统硅酸盐材料因其耐高温、抗腐蚀、强度高等优异性能,被广泛应用于各种工业、科学研究及日常生活中。某硅酸盐材料的主要成分为氧化钙、二氧化硅,并含有一定量铁、铝及镁的氧化物,某研究小组设计以下流程测定该硅酸盐材料中钙的含量(如下图所示)。

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度以0.1mol·L-1计)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Ca(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 7.6 | 12.3 | 4.0 | 8.0 |
完全沉淀pH | 3.7 | 9.6 | 14.3 | 5.2 | 12.4 |
回答下列问题:
(1)酸浸后,加入双氧水所发生反应的离子方程式为_________________。为提高钙的浸出率,可以采取的措施是________________________。(任写一种)
(2)沉淀B的成份为_____________。调节滤液Ⅰ的pH为4~5,加入的物质可以是_________。
A. CaCO3 B. Ca(OH)2 C. 氨水 D. MgO
(3)向滤液Ⅱ中加足量草酸铵溶液,在水浴上保温陈化2小时,冷却到室温,过滤、洗涤沉淀。将得到的CaC2O4沉淀溶解在硫酸中,并稀释配成250mL溶液。用移液管量取25.00 mL溶液于锥形瓶中,用KMnO4标准溶液滴定。滴定时发生反应的离子方程式为___________________________。若实验中所取样品质量为4.00 g ,KMnO4标准溶液浓度为0.0500 mol/L,平行滴定3次用去KMnO4标准溶液体积平均值为36.00 mL,则该硅酸盐样品中钙的质量分数为_________。
(4)在保温沉钙环节,若样品中镁的含量过高,会导致最终测定结果产生较大误差。试从理论上计算,加草酸铵溶液沉钙时,溶液中镁离子的浓度最高不能超过____mol/L。(已知:Ksp(CaC2O4) = 4.00×10-9,Ksp(MgC2O4) = 4.83×10-6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的主要污染物是 NO、NO2 和 CO。处理汽车尾气,可实现绿色环保、节能减排。
(1)用 NaOH 溶液吸收 NO、NO2,当 n(NO)∶n(NO2)=1 时只生成一种盐,该盐的化学式为 _________ 。
(2)已知:①CO 的燃烧热△H1=-282 kJ·mol-1;
②N2(g)+O2(g)=2NO(g)△H2=+183 kJ·mol1。
写出 NO 和 CO 反应生成无污染性气体的热化学反应方程式______________________。
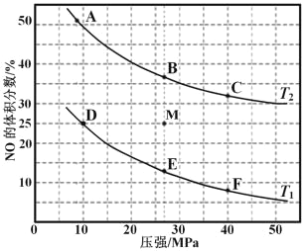
(3)在密闭容器中充入 10molCO 和 8molNO,发生反应,如图为平衡时 NO 的体积分数与温度,压强的关系。
①若反应在恒容密闭容器中进行,下列图像正确且能说明反应达到平衡状态的是_____。
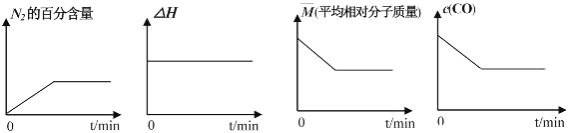
A B C D
②该反应达到平衡后,为在提高反应速率的同时提高 NO 的转化率,可采取的措施有_____(填字母)。
A.升高温度 B.缩小容器的体积
C.增加 CO 的浓度 D.改用高效催化剂
③在压强为 10MPa、温度为 T1 条件下,若反应进行到 20 min 达到平衡状态,容器的体积为 4 L,则此时 NO 的转化率=________________ ,用 N2 的浓度变化表示的平均反应速率 v(N2)= _______________,该温度下平衡常数 Kp=___________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留两位有效数字)。
④若在 M 点对反应容器降温,同时缩小体积至体系压强增大,重新达到的化学平衡状态可能是图中 A~F 点中的_____点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于消去反应的是( )
①CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
②2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
③CH3CH2CH2Br![]() CH3CH===CH2↑+HBr
CH3CH===CH2↑+HBr
④2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
⑤CH3CH2Br+NaOH ![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
⑥![]()
⑦CH3CH2OH![]() CH2===CH2↑+H2O
CH2===CH2↑+H2O
⑧CH3CH2OH+HCOOH![]() HCOOCH2CH3+H2O
HCOOCH2CH3+H2O
A. ⑤⑦⑧ B. ②③ C. ③④⑤ D. ③⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的位置如下图所示,若W原子最外层电子数是其内层电子总数的3/5。下列说法中,正确的是
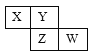
A. X只有一种氧化物
B. 气态氢化物的稳定性Z>W
C. 原子半径由大到小排列顺序Z>Y>X
D. 元素X是自然界中形成化合物种类最多的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构简式可进一步简化,如:
CH3CH2CH2CH3: 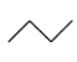 ,
,![]() :
: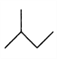 ,CH3CH=CHCH3 :
,CH3CH=CHCH3 :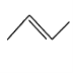
(1)写出下列有机物的结构简式:
2,2,3,3-四甲基戊烷:____________________;
3,4-二甲基-4-乙基庚烷:____________________。
(2)写出下列物质的分子式:
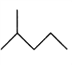 :__________________________;
:__________________________;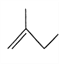 :__________________________。
:__________________________。
(3)用系统命名法命名下列物质:
![]() ____________________。
____________________。
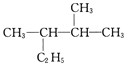 ____________________。
____________________。
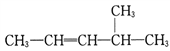 ____________________。
____________________。
![]() ____________________。
____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中,钢铁与食盐水接触,发生吸氧腐蚀,在负极上发生的电极反应是( )
A. Fe-2e-=Fe2+B. 2H++2e-=H2↑
C. Na++e-=NaD. 2H2O+O2+4e-=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com