
 CO2↑+4NO2↑+2H2O,反应中电子转移数目为4,标出电子转移的方向和数目为:
CO2↑+4NO2↑+2H2O,反应中电子转移数目为4,标出电子转移的方向和数目为: ;
; ;
; CO2↑+4NO2↑+2H2O,假定生成CO2为1mol、NO2为4mol,产生的气体依次通过足量的碳酸氢钠溶液,发生反应3NO2+H2O=2HNO3+NO,生成
CO2↑+4NO2↑+2H2O,假定生成CO2为1mol、NO2为4mol,产生的气体依次通过足量的碳酸氢钠溶液,发生反应3NO2+H2O=2HNO3+NO,生成 molHNO3,
molHNO3, molNO,同时发生HNO3+NaHCO3=CO2↑+H2O,
molNO,同时发生HNO3+NaHCO3=CO2↑+H2O, molHNO3可以生成
molHNO3可以生成 molCO2,故出来气体中:CO2为1mol+
molCO2,故出来气体中:CO2为1mol+ mol=
mol= mol,NO为
mol,NO为 mol,及水蒸气.通过浓硫酸水被吸收,再通过足量Na2O2固体发生反应2Na2O2+2CO2=2Na2CO3+O2,
mol,及水蒸气.通过浓硫酸水被吸收,再通过足量Na2O2固体发生反应2Na2O2+2CO2=2Na2CO3+O2, molCO2生成
molCO2生成 molO2,再发生2NO+O2=2NO2,
molO2,再发生2NO+O2=2NO2, molNO,消耗
molNO,消耗 molO2,剩余O2为
molO2,剩余O2为 mol-
mol- mol=
mol= mol,生成NO2
mol,生成NO2 mol,最后发生反应4NO2+O2+2H2O=4HNO3,
mol,最后发生反应4NO2+O2+2H2O=4HNO3, molNO2消耗
molNO2消耗 molO2,最后剩余O2为
molO2,最后剩余O2为 mol-
mol- mol=
mol= mol,故最终得到的气体与原气体的体积比为
mol,故最终得到的气体与原气体的体积比为 mol:(1mol+4mol)=1:6;
mol:(1mol+4mol)=1:6;

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
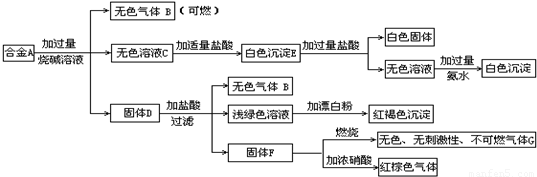
试填写下列空白:
(1)A中所含单质为________________(写化学式)。
(2)写出A中能与烧碱溶液反应的离子方程式_______________________________________。
(3)写出固体F与浓硝酸反应的化学方程式,并标出电子转移的方向和数目,指出氧化产物__________________。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源: 题型:
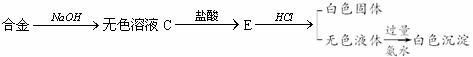
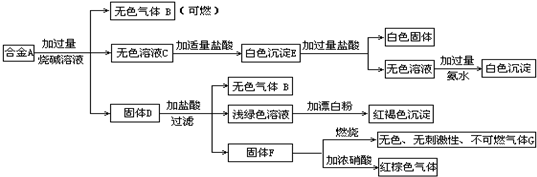
现有四种单质组成的合金A,为分析其成分,用此合金进行一系列实验,其过程及发生反应的现象如下图所示。
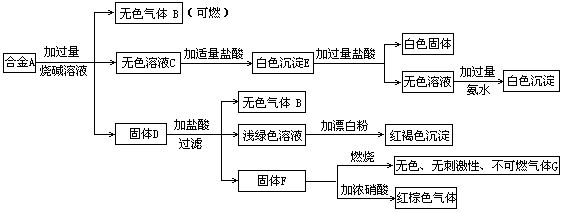 填写下列空白:
填写下列空白:
(1)A中含单质为 (写化学式);G的电子式为 。
(2)写出A中的某单质与烧碱溶液反应的离子方程式_____ _.
(3)写出固体F与硝酸反应的化学方程式,并标出电子转移的方向和数目
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com