(2010?青岛二模)现有A、B、C、D、E五种短周期元素,已知他们的原子序数依次增大,元素A的原子只有一个电子层;又知元素A能分别与元素B、C、D形成电子总数相等的化合物分子X、Y、Z,Y有刺激性气味,Z常温下为液态,元素E的单质的水溶液有漂白性.
请回答下列问题:
(1)元素E的单质的饱和溶液与石灰石反应后所得溶液的漂白性增强的原因是
元素E的单质为Cl
2,在氯水中存在以下平衡Cl
2+H
2O
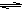
HCl+HClO,CaCO
3与氯水中的HCl反应,使c(H
+)减小,平衡向右移动,HClO浓度增大,故漂白性增强
元素E的单质为Cl
2,在氯水中存在以下平衡Cl
2+H
2O
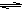
HCl+HClO,CaCO
3与氯水中的HCl反应,使c(H
+)减小,平衡向右移动,HClO浓度增大,故漂白性增强
;
(2)在锅炉水中加入C
2A
4,可以把锅炉表面的氧化铁还原为结构紧密的四氧化三铁保护层,C
2A
4 被氧化,且反应中无污染物生成,写出反应的化学方程式(不必配平)
6Fe2O3+N2H4=4Fe3O4+N2↑+2H2O
6Fe2O3+N2H4=4Fe3O4+N2↑+2H2O
,1mol C
2A
4 参加反应转移电子的数目为
4NA
4NA
,氧化产物的化学式为
N2
N2
;
(3)化合物Y与元素C的最高正价氧化物的水化物按物质的量比为2:1完全反应后的水溶液呈
碱
碱
性(填“酸”“碱”或“中”),溶液中离子浓度由大到小的顺序为
c(NH4+)>c(NO3-)>c(OH-)>c(H+)
c(NH4+)>c(NO3-)>c(OH-)>c(H+)
;
(4)用X、D
2和能传导O
2-的固体电解质组成的原电池中,负极的电极反应式为
CH4+4O2--8e-=CO2+2H2O
CH4+4O2--8e-=CO2+2H2O
.
(5)A、B、D三种元素可以形成最简式为B
2A
4D且有香味的有机物,该有机物在酸性条件下可以水解,生成含碳原子数相同的两种常见有机物,这两种有机物均可用作食品调味剂.则这种有香味的有机物在一定条件下水解的化学方程式是
CH
3COOCH
2CH
3+H
2O
CH
3COOH+CH
3CH
2OH
CH
3COOCH
2CH
3+H
2O
CH
3COOH+CH
3CH
2OH
.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案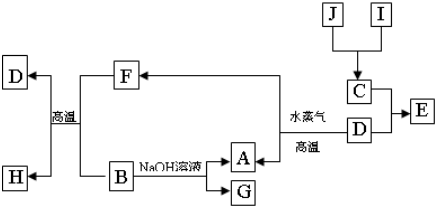
 Al(OH)3+OH-
Al(OH)3+OH- Al(OH)3+OH-
Al(OH)3+OH-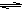 HCl+HClO,CaCO3与氯水中的HCl反应,使c(H+)减小,平衡向右移动,HClO浓度增大,故漂白性增强
HCl+HClO,CaCO3与氯水中的HCl反应,使c(H+)减小,平衡向右移动,HClO浓度增大,故漂白性增强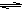 HCl+HClO,CaCO3与氯水中的HCl反应,使c(H+)减小,平衡向右移动,HClO浓度增大,故漂白性增强
HCl+HClO,CaCO3与氯水中的HCl反应,使c(H+)减小,平衡向右移动,HClO浓度增大,故漂白性增强

 HSO3-+OH-
HSO3-+OH- HSO3-+OH-
HSO3-+OH-