
(18分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。

②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v (N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。

①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L 的醋酸与b mol
的醋酸与b mol L
L Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
(1)① > ②0.01 mol·L-1·s-1 14.3%
(2)①SO2 + 2H2O – 2e-== SO42-+ 4H+ ②1:2
(3)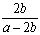 ×10-7 mol·L-1 (不写单位也给分)
×10-7 mol·L-1 (不写单位也给分)
【解析】
试题分析:(1)①根据题给图像判断,一定量的NO发生分解反应时,温度为T2时反应先到达平衡,反应速率大,温度较高,即T2>T1;而温度升高,氮气的体积分数减小,说明升高温度平衡向逆向移动,升高温度平衡向吸热方向移动,故NO的分解反应为放热反应,则N2(g)+O2(g) 2NO(g)为吸热反应,△H>0;②利用三行式计算。
2NO(g)为吸热反应,△H>0;②利用三行式计算。
N2(g)+O2(g) 2NO(g),
2NO(g),
起始(mol/L):5 2.5 0
反应(mol/L):0.5 0.5 1
平衡(mol/L):4.5 2 1
所以v (N2)=△c(N2)/△t=0.01 mol·L-1·s-1,平衡常数k=c2(NO)/c(N2)?c(O2)=1/4.5×2=1/9;
设N2转化浓度为x,则
N2(g)+O2(g) 2NO(g),
2NO(g),
起始(mol/L):0.5 0.5 0
反应(mol/L):x x 2x
平衡(mol/L):0.5-x 0.5-x 2x
则4x2/(0.5—x)2=1/9;,解得x=1/14,N2的转化率为1/14×0.5×100%=14.3%
(2)①根据题给装置图判断,该装置为电解池。二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,电极反应式为SO2-2e-+2H2O═SO42-+4H+。②在碱性条件下,用阴极排出的溶液S2O42-吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应的化学方程式为2NO2+4S2O42-+8OH- 8SO32—+N2+4H2O,其中氧化剂为NO2,还原剂为S2O42-,物质的量之比为1:2。(3)常温下,将a mol·L—1的醋酸与b mol·L—1Ba(OH)2溶液等体积混合,发生的反应为
8SO32—+N2+4H2O,其中氧化剂为NO2,还原剂为S2O42-,物质的量之比为1:2。(3)常温下,将a mol·L—1的醋酸与b mol·L—1Ba(OH)2溶液等体积混合,发生的反应为
2CH3COOH+Ba(OH)2 (CH3COO)2Ba+2H2O,反应后溶液中存在2c(Ba2+)=c(CH3COO-)=b mol·L—1,根据电荷守恒知,c(H+)=c(OH-)=1×10—7 mol·L—1,溶液呈中性,则反应后醋酸有剩余,混合溶液中剩余醋酸的浓度为(a—2b)/2 mol·L—1,电离常数Ka=c(CH3COO-)c(H+)/c(CH3COOH)=
(CH3COO)2Ba+2H2O,反应后溶液中存在2c(Ba2+)=c(CH3COO-)=b mol·L—1,根据电荷守恒知,c(H+)=c(OH-)=1×10—7 mol·L—1,溶液呈中性,则反应后醋酸有剩余,混合溶液中剩余醋酸的浓度为(a—2b)/2 mol·L—1,电离常数Ka=c(CH3COO-)c(H+)/c(CH3COOH)=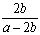 ×10-7 mol·L-1。
×10-7 mol·L-1。
考点:考查化学平衡图像及平衡计算,电解原理应用、氧化还原方程式的书写,电离常数计算。


科目:高中化学 来源:2013-2014山东省济宁市高二年级第二学期阶段考试化学试卷(解析版) 题型:选择题
某同学在实验报告中记录下列数据,其中正确的( )
A.用25mL量筒量取18.63mL盐酸
B.用托盘天平称取12.15克食盐
C.标准的NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液32.30mL
D.用广泛pH试纸(1~14)测得某溶液pH为5.5
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济南市高三5月针对性训练理综化学试卷(解析版) 题型:选择题
全国“两会”期间,山东代表提出“向污染宣战”的倡议。下列做法中,不符合“治理污染、保护环境”这一理念的是
A.大力发展工业除尘技术,严控PM2.5
B.向含重金属离子的工业废水中加入明矾,然后再将废水排放
C.将炼铁时产生的高炉矿渣加工成多种工业原料
D.推进燃油的品质升级,致力于缓解雾霾产生
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省枣庄市2013-2014学年高三3月调研考试理综化学试卷(解析版) 题型:简答题
(22分)研究碳及其化合物的性质和用途是中学化学的任务之一。
I.某兴趣小组在实验室中制备碳酸钠溶液。方案如下:步骤一,取25 mL一定浓度的NaOH溶液,通人CO2气体至过量;步骤二,加热煮沸步骤一所得溶液;步骤三,另取25 mL相同浓度的NaOH溶液与步骤二所得溶液混合,即得碳酸钠溶液。
(1)完成步骤一可选的化学试剂有:稀盐酸、NaOH溶液、大理石、饱和碳酸钠溶液、稀硫酸、饱和碳酸氢钠溶液等,需要的装置如下所示。
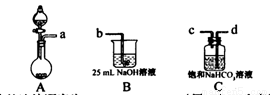
①各装置正确的连接顺序为 (用a、b、c、d表示)。
②检查整套装置气密性的方法是 。
③装置A中常用药品为 ;装置C中化学药品的作用是 。
(2)写出步骤三中发生反应的离子方程式 。
(3)有同学提出“步骤二”没有必要,请你简述自己的看法 。
Ⅱ.实验室用纯碱和盐酸处理某种蛇纹石(已知蛇纹石中含有MgO、SiO2.CaO、Fe2O3、Al2O3等氧化物)模拟制备氧化镁的流程如下:
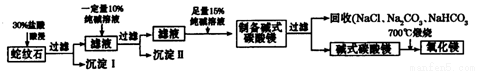
(1)过滤需要的玻璃仪器有 。
(2)沉淀Ⅱ的成分为 ,请用离子方程式表示生成沉淀的过程 (写出一个即可)。
(3)纯碱溶液中所有离子浓度的大小关系为 。
(4)已知l0%的纯碱溶液密度为1.06g/cm3,则其物质的量浓度为____ ,
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省枣庄市2013-2014学年高三3月调研考试理综化学试卷(解析版) 题型:选择题
绿原酸又叫咖啡鞣酸,是一种抗氧化药物,其结构简式如图所示。下列关于绿原酸的说法不正确的是
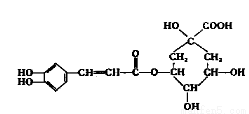
A.分子式为C16H18O9
B.分子中含有6个醇羟基
C.可以与氢氧化钠溶液发生反应
D.既能使酸性高锰酸钾溶液退色,又能使溴的四氯化碳溶液退色,但两者反应类型不同
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省日照市高三5月二模理综化学试卷(解析版) 题型:选择题
下列有关实验的描述正确的是
A.用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性
B.中和滴定实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须干燥 或用待装液润洗后方可使用
C.将碘水倒入分液漏斗,加入适量乙醇,振荡后静置,能将碘萃取到乙醇中
D.向含有FeCl2杂质的FeCl3溶液中通入足量C12后,充分加热蒸干,可得到纯净的FeCl3固体
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省6月月考高一化学必修2试卷(解析版) 题型:填空题
I.丙烯酸的结构简式是:CH2 CHCOOH。试写出它与下列物质反应的化学方程式。
(1)氢氧化钠溶液________________________________________。
(2)溴水________________________________________。
(3)乙醇________________________________________。
II.4.6g某有机物完全燃烧,得到8.8g二氧化碳和5.4g水.此有机物的蒸气对氢气的相对密度为23(相同状况下).该有机物与金属钠反应放出氢气.其分子式为 ,结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高二化学试卷(解析版) 题型:填空题
(15分)写出下列反应的化学方程式:
(1)乙醛和银氨溶液反应 ;
(2)苯酚溶液和浓溴水的反应 ;
(3)1-溴丙烷和NaOH醇溶液共热 ;
(4)用苯制溴苯的反应 ;
(5)乙醇的催化氧化
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高一化学试卷(解析版) 题型:选择题
下列有关能量的说法不正确的是 ( )
A. 化石能源物质内部贮存着大量的能量
B. 植物的光合作用使太阳能转化为化学能
C. 燃料燃烧时只是将化学能转化为热能
D.由石墨制金刚石是吸热反应,故石墨能量比金刚石能量低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com