
【题目】在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:
PCl3(g)+ Cl2(g) PCl5(g);5min末达到平衡,有关数据如右表。
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(molL—1) | 2.0 | 1.0 | 0 |
平衡浓度(molL—1) | C1 | C2 | 0.4 |
下列判断不正确的是
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)="0.08" molL-1min-1
C.当容器中为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 molL—1
【答案】A
【解析】
A项、升高温度,反应的平衡常数减小,则平衡逆向移动,所以正反应为放热反应,故A错误;
B项、由题意建立如下三段式:
PCl3(g)+Cl2(g)![]() PCl5(g)
PCl5(g)
初始浓度/mol·L-1 2.0 1.0 0
转化浓度/mol·L-1 0.4 0.4 0.4
平衡浓度/mol·L-1 1.6 0.6 0.4
则v(PCl3)= ![]() mol·L-1·min-1=0.08"mol·L-1·min-1,故B正确;
mol·L-1·min-1=0.08"mol·L-1·min-1,故B正确;
C项、由上述三段式计算可知,c(Cl2)= 0.6 mol·L-1,n(Cl2)=1.2mol,故C正确;
D项、反应的化学平衡常数K=![]() =
=![]() ,平衡后移走2.0 mol PCl3和1.0 mol Cl2,c(PCl3)=0.6mol·L-1,c(Cl2)=0.1mol·L-1,由温度不变化学平衡常数不变可解得c(PCl5)=
,平衡后移走2.0 mol PCl3和1.0 mol Cl2,c(PCl3)=0.6mol·L-1,c(Cl2)=0.1mol·L-1,由温度不变化学平衡常数不变可解得c(PCl5)=
0.025 mol·L-1,故D正确;
故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知![]()
![]()
![]()
![]() ;
;![]() 向同温、同体积的三个密闭容器中分别充入气体:
向同温、同体积的三个密闭容器中分别充入气体:![]() 甲
甲![]() 2mol
2mol![]() 和1mol
和1mol![]() ;
;![]() 乙
乙![]() 1mol
1mol![]() 和
和![]()
![]() ;
;![]() 丙
丙![]() 2mol
2mol![]() 恒温、恒容下反应达平衡时,下列关系一定正确的是
恒温、恒容下反应达平衡时,下列关系一定正确的是![]()
A.容器内压强P:![]()
B.![]() 的质量m:
的质量m:![]()
C.![]() 与
与![]() 之比N:
之比N:![]()
D.反应放出或吸收热量的数值Q:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3—环己二酮(![]() )常用作医药中间体,用于有机合成。1,3—环己二酮的一种合成路线如图所示。
)常用作医药中间体,用于有机合成。1,3—环己二酮的一种合成路线如图所示。
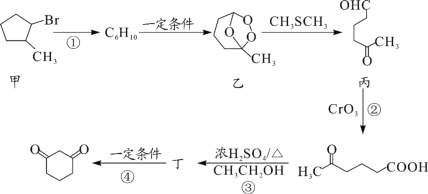
回答下列问题:
(1)甲的分子式为___。
(2)丙中含有官能团的名称是___。
(3)反应①所需的试剂和条件是___;②的反应类型是___。
(4)丁的结构简式为___。
(5)写出丙与新制氢氧化铜悬浊液反应的化学方程式___。
(6)符合下列条件的乙的同分异构体共有___种。
①能发生银镜反应
②能与NaHCO3溶液反应
其中核磁共振氢谱峰面积之比为1∶1∶2∶6的一种同分异构体的结构简式为___(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是( )
①C(s)+O2(g)=CO2(g) △H1 C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③H2(g)+![]() O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①写出漂白粉的有效成分的化学式:________________
②写出甘氨酸的结构简式:_______________
(2)写出苯和浓硝酸在浓H2SO4催化作用下,50~60℃时生成硝基苯的方程式:_______________
(3)相对分子质量为58的烷烃,它可能的结构简式:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】间苯二酚大环内酯具有较强的抗癌活性,其结构简式如图。下列有关间苯二酚大环内酯的说法不正确的是( )
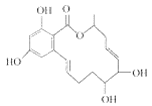
A.能使酸性KMnO4溶液褪色
B.能与FeCl3溶液发生显色反应
C.能与浓溴水发生加成反应和取代反应
D.属于油脂类化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用酸性溶液为电解液;则氢气应通入____极 (填a或b)。a极发生电极反应式为:____________
II.某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下( 累计值,体积已换算成标准状态) :

(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大_______ ,原因是______________
(2)哪一时间段的反应速率最小________,原因是_________________________。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率( 设溶液体积不变)________
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A. 蒸馏水 B. NaCl溶液C. Na2CO3溶液D. CuSO4溶液
可行的是(填编号)________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S16O2与18O2在高温条件下发生反应2SO2+O2![]() 2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
A. 只有SO3 B. 只有SO2、SO3 C. 有SO2、SO3、O2 D. 只有O2、SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是( )
A.pH均为4的H2SO4、NH4Cl溶液中,水的电离程度相同
B.等pH的NaOH溶液与NH3H2O 稀释后pH的变化如右图所示,则曲线I表示的是NaOH溶液的稀释
C.1mol/LNa2CO3溶液中存在:c(Na+)=2c(CO32﹣)+2c(HCO3﹣)
D.向某温度的氨水中通入盐酸,则氨水的电离常数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com