
| A. | 单质铁与盐酸的反应 Fe+2 H+=Fe2++H2↑ | |
| B. | 氨水跟硫酸发生酸碱中和反应 OH-+H+=H2O | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钙加入醋酸溶液中 CaCO3+2CH3COOH=CO2↑+2CH3COO-+H2O+Ca2+ |
分析 A.铁与盐酸反应生成氯化亚铁了氢气;
B.一水合氨为弱电解质,保留化学式;
C.电荷不守恒;
D.碳酸钙与醋酸反应生成醋酸钙、水和二氧化碳.
解答 解:A.单质铁与盐酸的反应,离子方程式:Fe+2H+=Fe2++H2↑,故A正确;
B.氨水跟硫酸发生酸碱中和反应,离子方程式:NH3•H2O+H+=H2O+NH4+,故B错误;
C.铜片插入硝酸银溶液中,离子方程式:Cu+2Ag+=Cu2++2Ag,故C错误;
D.碳酸钙加入醋酸溶液中,离子方程式:CaCO3+2CH3COOH=CO2↑+2CH3COO-+H2O+Ca2+,故D正确;
故选:AD.
点评 本题考查了离子方程式的书写,明确离子方程式书写方法及化学式拆分原则是解题关键,注意离子方程式遵循原子个数守恒、电荷守恒规律.


科目:高中化学 来源: 题型:选择题
| A. | 经实验测定等物质的量的盐酸、醋酸分别与足量NaOH溶液反应放出的热量相等 | |
| B. | 中和热测定实验中可以用环形铁丝搅拌棒代替环形玻璃搅拌棒 | |
| C. | 用碱式滴定管量取0.10 mol•L-1的Na2CO3溶液22.10 mL | |
| D. | 用玻璃棒蘸取溶液滴到湿润的广范pH试纸上,测其pH=3.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: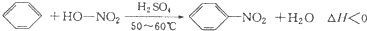
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
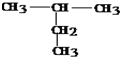 :2-甲基丁烷
:2-甲基丁烷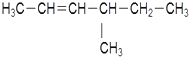 :4-甲基-2-己烯
:4-甲基-2-己烯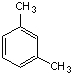 1,3-二甲苯.
1,3-二甲苯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
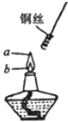 如图,某同学做乙醇氧化实验时,将螺旋状铜丝先放到a点处加热,然后再移到b点,发现铜丝在火焰a、b两点时现象明显不同.请你写出a、b两点的实验现象,并解释产生该现象的原因,并写出化学反应方程式.
如图,某同学做乙醇氧化实验时,将螺旋状铜丝先放到a点处加热,然后再移到b点,发现铜丝在火焰a、b两点时现象明显不同.请你写出a、b两点的实验现象,并解释产生该现象的原因,并写出化学反应方程式.| 实验现象 | 解释 | 化学方程式 | |
| a | |||
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2作呼吸面具中的供氧剂 | |
| B. | 硫磺用于制火药 | |
| C. | 镁合金用于制造汽车、飞机、火箭 | |
| D. | BaCO3作“钡餐”--检查肠胃的内服药 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com