
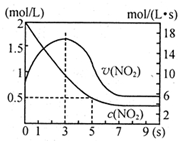
 某绝热恒容容器中充入2mol/L NO2,发生反应2NO2?N2O4 △H=-56.9kJ/mol下列分析不正确的是( )
某绝热恒容容器中充入2mol/L NO2,发生反应2NO2?N2O4 △H=-56.9kJ/mol下列分析不正确的是( )| A、5s时NO2的转化率为75% |
| B、0-3s时v(NO2)增大是由于体系温度升高 |
| C、3s时化学反应处于平衡状态 |
| D、9s时再充入N2O4,平衡后K较第一次平衡时大 |
| 消耗量 |
| 起始量 |
| 消耗量 |
| 起始量 |
| 1.5mol/L |
| 2mol/L |


科目:高中化学 来源: 题型:
| A、甲苯是饱和烃,氯乙烯是不饱和烃 |
| B、石油的裂化产品能使溴水褪色 |
| C、蛋白质在CuSO4溶液中发生盐析 |
| D、油脂在NaOH溶液中水解生成高级脂肪酸和甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合后溶液中存在有关系:C(K+)+C(Na+)+C(H+)=C(SO32-)+C(HSO3-)+C(OH-) |
| B、混合后溶液中存在有关系:C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-) |
| C、混合后溶液中存在有关系:C(SO32-)+C(HSO3-)+C(H2SO3)=0.02 mol?L-1 |
| D、两溶液混合前,Na2SO3溶液中水电离出C(H+)小于KHSO3溶液中水电离出C(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
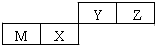
| A、原子半径Z>Y |
| B、X的最简单气态氢化物的热稳定性比Z的小 |
| C、Y的最高价氧化物对应水化物的酸性比X的弱 |
| D、M的最高价氧化物对应水化物不能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| OH- |
| H- |
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A、pH=7的血液中,c(HCO3-)>c(H2CO3) |
| B、人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒 |
| C、常温下将pH=7.40的血液稀释至pH=7时,c(H+)?c(OH-)一定不变 |
| D、c(HCO3-):c(H2CO3)=1时,H2CO3的电离程度小于HCO3-的水解程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高吸水性树脂属于功能高分子材料 |
| B、SiC、Al2O3的熔点很高,可用作高温结构陶瓷 |
| C、光导纤维、合成纤维和人造纤维都是有机高分子化合物 |
| D、合金拓展了金属材料的使用范围,合金中也可能含有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、冰熔化时水分子的共价键未发生断裂 |
| B、同族元素的氧化物形成的晶体类型相同 |
| C、分子晶体中,分子间作用力越大,分子越稳定 |
| D、具有高熔沸点的晶体一定是离子晶体或原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用18.4mol/L的浓H2SO4配制500ml0.5mol/L的稀H2SO4,请按要求填空:
用18.4mol/L的浓H2SO4配制500ml0.5mol/L的稀H2SO4,请按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | F | Ne | |||||
| 3 | Na | Mg | Al | Si | Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com