
(13分) 四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 A B C D
性质
结构
信息 原子核外有两个电子层,最外层有3个未成对的电子 原子的M层有1对成对的p电子 原子核外电子排布为[Ar]3d104s1,
有+1、+2两种常见化合价 有两种常见氧化物,其中有一种是冶金工业常用的还原剂
⑴写出B原子的电子排布式 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其是__________________________。
⑶D的最高价氧化物的电子式: 。高温下D的氧化物还原赤铁矿的方程式为可逆反应,写出该反应的化学方程式___________________,该反应的平衡常数表达式K=___________。
⑷往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为________________,简要描述该配合物中化学键的成键情况__________________。
⑸下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。

则在以上分子中,中心原子采用sp3杂化形成化学键的且空间构型是角形的是 (填写序号);在②的分子中有 个σ键和 个π键。
⑹已知NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为 \s\up10(∣←N-,\s\up10(∣H(→表示共用电子对由N原子单方面提供)。 请画出N4H44+的结构式_____________________。
⑴ 1s22s22p63s23p4 (1分)
⑵高,因为A的氢化物存在氢键(各1分)
⑶  Fe2O3(s) +
3CO(g)
Fe2O3(s) +
3CO(g) 2Fe(s) + 3CO2(g) K=C3(CO2)/ C3(CO)(各1分)
2Fe(s) + 3CO2(g) K=C3(CO2)/ C3(CO)(各1分)
⑷[Cu(NH3)4]SO4(1分),中心原子与配位体之间以配位键相结合,内界与外界之间以离子键相结合(1分)⑸ ④(1分)3 (1分) 2(1分)
⑹ 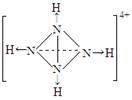 (2分)
(2分)
【解析】
试题分析:B原子的M层有1对成对的p电子,说明M层电子数是4,所以B原子的电子排布式1s22s22p63s23p4 ;,
A原子核外有两个电子层,最外层有3个未成对的电子所以A原子L层电子数是5即是N原子,A元素的氢化物的沸点比同主族相邻元素氢化物沸点高,因为A的氢化物存在氢键;
D有两种常见氧化物,其中有一种是冶金工业常用的还原剂,是CO所以D的最高价氧化物的电子式 ,高温下D的氧化物还原赤铁矿的方程式为可逆反应,该反应的化学方程式Fe2O3(s)
+ 3CO(g)
,高温下D的氧化物还原赤铁矿的方程式为可逆反应,该反应的化学方程式Fe2O3(s)
+ 3CO(g) 2Fe(s) + 3CO2(g) ;
该反应的平衡常数表达式K=C3(CO2)/
C3(CO) ;C原子核外电子排布为[Ar]3d104s1,有+1、+2两种常见化合价
2Fe(s) + 3CO2(g) ;
该反应的平衡常数表达式K=C3(CO2)/
C3(CO) ;C原子核外电子排布为[Ar]3d104s1,有+1、+2两种常见化合价
所以C原子时Cu,C元素的硫酸盐溶液是硫酸铜溶液,逐滴加入过量A元素的氢化物水溶液是氨水,可生成的配合物的化学式为[Cu(NH3)4]SO4,该配合物中化学键的成键情况是中心原子与配位体之间以配位键相结合,内界与外界之间以离子键相结合;中心原子采用sp3杂化形成化学键的且空间构型是角形的是 ④;在②的分子中有3个σ键和 2个π键;已知NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为 \s\up10(∣←N-,\s\up10(∣H
;N4H44+的结构式是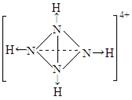
考点:元素的性质或结构 配位键
点评:对于某元素原子的核外电子排布情况,先确定该原子的核外电子数(即原子序数、质子数、核电荷数),然后将电子从能量最低的1s亚层依次往能量较高的亚层上排布,只有前面的亚层填满后,才去填充后面的亚层,每一个亚层上最多能够排布的电子数为:s亚层2个,p亚层6个,d亚层10个,f亚层14个。最外层电子到底怎样排布,还要参考洪特规则
洪特规则
从光谱实验结果总结出来的洪特规则有两方面的含义:一是电子在原子核外排布时,将尽可能分占不同的轨道,且自旋平行;洪特规则的第二个含义是对于同一个电子亚层,当电子排布处于全满(s2、p6、d10、f14)半满(s1、p3、d5、f7)全空(s0、p0、d0、f0)时比较稳定。
配位键:一个原子提供一对电子与另一个接受电子的原子形成的共价键.即成键的两个原子一方提供孤对电子,一方提供空轨道而形成的共价键。
(2)①.配合物:由提供孤电子对的配位体与接受孤电子对的中心原子(或离子)以配位键形成的化合物称配合物,又称络合物。
②形成条件:a.中心原子(或离子)必须存在空轨道. b.配位体具有提供孤电子对的原子。
③配合物的组成。
④配合物的性质:配合物具有一定的稳定性.配合物中配位键越强,配合物越稳定.当作为中心原子的金属离子相同时,配合物的稳定性与配体的性质有关。


科目:高中化学 来源: 题型:阅读理解
| 元素 | A | B | C | D |
| 性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“?”表示没有形成共价键的最外层电子,短线表示共价键.
”表示氢原子,小黑点“?”表示没有形成共价键的最外层电子,短线表示共价键.
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质 结构 信息 |
基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104s2 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D | 性质、结构信息 | 价电子数为5的短周期元素;该元素形成的双原子分子一般情况下很稳定. | 基态原子的M层有1对成对的p电子. | 第三周期中电离能最小的元素. | 原子L电子层上s电子数等于p电子数. 单质为空间网状晶体,具有很高的熔、沸点. |
查看答案和解析>>
科目:高中化学 来源:2009—2010泉州七中学年度下学期高二年期中考试化学卷 题型:填空题
(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。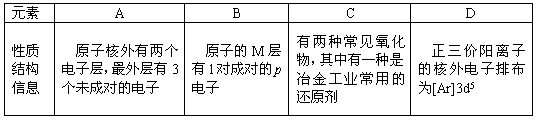
⑴写出B原子的电子排布式 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
⑶D元素的某价态阳离子可与KCN溶液形成一种俗称黄血盐的配合物甲,甲的化学式可表示为K4[D(CN)6],则中心原子D的化合价为 ,甲在水溶液中的电离方程式为 ;已知D元素的另一种价态的离子可与KCN溶液形成另一种配合物乙,乙的配位数与甲相同,则乙的化学式为 。 ⑷下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
⑷下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。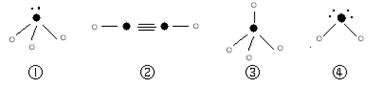
则在以上分子中,中心原子没有采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省丹东市宽甸二中高二上学期期末考试化学试卷(带解析) 题型:填空题
(13分) 四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104s1, 有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。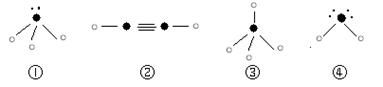
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com