
下列离子方程式正确的是
A.铁和硝酸银溶液反应 Fe+Ag+=3Ag+Fe3+
B.氢氧化镁与硫酸溶液反应 OH-+H+=H2O
C.铁与稀硫酸反应 2Fe+6H+=2Fe3++3H2↑
D.碳酸钙与盐酸反应 CaCO3+2H+= Ca2++CO2↑+H2O
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源:2014-2015学年河南郑州市高一上10月月考化学试卷(解析版) 题型:填空题
(1)等质量的O2、CH4、H2的物质的量的比值为_ 。
(2)38g某二价金属氯化物(ACl2)中含有0.8mol Cl-,则ACl2的摩尔质量是________;A的相对原子质量是____________;ACl2的化学式是__________。
新制备的氯水显__________色,说明氯水中有__________(填分子式)分子存在。
(4)向氯水中滴加几滴AgNO3溶液,立即有__________生成,说明氯水中有__________(填离子符号)存在,反应的化学方程式为_____________ ___氯水光照后颜色变浅,并放出___ __气体。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高二上学期期中化学试卷(解析版) 题型:选择题
某原电池装置如图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是
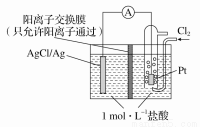
A.当电路中转移0.1 mol e-时,交换膜左侧溶液中约减少0.2 mol离子
B.放电时,交换膜两侧溶液中均有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.正极反应为AgCl+e-===Ag+Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高一上学期期中化学试卷(解析版) 题型:实验题
(12分)(实验题)下图为配制250 mL 0.2 mol/L Na2CO3溶液的示意图。

回答下列问题:
(1)①中称得Na2CO3________g;选取容量瓶规格:______________
(2)容量瓶使用前检验漏水的方法是 ____________________。
(3)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”“偏低”或“无影响”)
A.某同学在第⑧步观察液面时俯视________;
B.没有进行操作步骤④和⑤________;
C.在第⑤步不慎有少量液体流到容量瓶外 ________。
D.未经冷却趁热将溶液注入容量瓶中定容 ________。
E.摇匀后发现液面低于刻度线再加水 _______
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高一上学期期中化学试卷(解析版) 题型:选择题
下列各组中的离子,能在溶液中大量共存的是
A.Na+、H+、SO42-、OH-
B.K+、Ca2+、CO32-、NO3-
C.Na+、H+、Cl-、CO32-
D.K+、Cu2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省洛阳市高二10月月考化学试卷(解析版) 题型:填空题
(1)工业制氢气的一个重要反应是:CO(g)+ H2O(g) == CO2(g) + H2(g)
已知25℃时:C(石墨) +O2 (g) == CO2(g) △H1 =-394 kJ·mol-1
C(石墨) +1/2O2 (g) == CO (g) △H2 =-111 kJ·mol-1
H2(g) +1/2O2 (g)== H2O(g) △H3=-242kJ·mol-1
试计算25℃时CO(g)+ H2O(g) == CO2(g) + H2(g)的反应热______kJ·mol-1
(2)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g)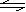 CO2(g)+H2(g);△H<0 试回答下列问题:
CO2(g)+H2(g);△H<0 试回答下列问题:
①若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
②在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是
③若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省洛阳市高二10月月考化学试卷(解析版) 题型:选择题
在温度和容积不变的容器中,一定条件下发生下列变化:H2(g)  2H(g)(气态氢原子)。ΔH >0。当容器中H2的浓度从0.1mol/L变为0.06mol/L时,需20秒,那么H2的浓度由0.06mol/L下降到0.036mol/l时需时间:( )
2H(g)(气态氢原子)。ΔH >0。当容器中H2的浓度从0.1mol/L变为0.06mol/L时,需20秒,那么H2的浓度由0.06mol/L下降到0.036mol/l时需时间:( )
A.12秒 B.无法判断 C.大于12秒 D. 小于12秒
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省汝州市高二上学期第一次月考化学试卷(解析版) 题型:选择题
以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=-Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=-Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H=-Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是 ( )
A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com