
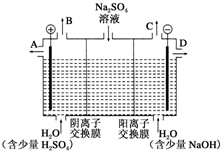
 芒硝化学式为Na2SO4•10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
芒硝化学式为Na2SO4•10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.分析 ①电解时,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,阳极上失电子发生氧化反应;根据阴阳离子的移动方向,通过相同电量时,阴阳离子交换的个数判断;
②阴极上氢离子放电,则NaOH在阴极生成;
③电解过程中氢离子在阴极得到电子发生还原反应,破坏了水的电离,溶液中氢氧根离子浓度增大,溶液pH升高;
④氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,负极上氢气失去电子;结合燃烧热方程式及电池反应计算.
解答 解:①电解时,阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,所以阳极上氢氧根离子失电子生成水和氧气,阳极电极反应为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
②阴极上氢离子放电,则NaOH在阴极生成,由图可知,D在阴极附近,制得的氢氧化钠溶液从D出口导出,故答案为:D;
③电解过程中氢离子在阴极得到电子发生还原反应,破坏了水的电离,溶液中氢氧根离子浓度增大,溶液pH升高;
故答案为:H+放电促进水的电离,使OH-浓度增大;
④氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,负极上氢气失去电子,负极反应式为:H2-2e-+2OH-=2H2O,
H2的燃烧热为285.8kJ/mol,则2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol,该燃料电池工作产生36g H2O,n(H2O)=$\frac{36g}{18g/mol}$=2mol,由燃烧的热方程式可知,生成2molH2O放出571.6kJ的热量,即理论上有571.6kJ的能量转化为电能;
故答案为:H2-2e-+2OH-=2H2O;571.6.
点评 本题考查了原电池和电解池原理,为高频考点,注意装置的判断及燃料原电池电极反应式和电解反应的书写,理解电解质溶液的酸碱性确定生成的离子或物质,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 互为同系物 | B. | 均可发生硝化反应 | ||
| C. | 均可与碳酸氢钠反应 | D. | 均最多有7个碳原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g 46%的乙醇溶液所含氢原子数为1.2NA | |
| B. | 0.5mol Na2O2中含有的离子数目为2NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | S2和S8的混合物共38.4g,其中所含硫原子数为1.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-4b kJ/mol | |
| B. | C2H2(g)+$\frac{5}{2}$O2(g) 2CO2(g)+H2O(l);△H=2b kJ/mol | |
| C. | 2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-2b kJ/mol | |
| D. | 2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=b kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期ⅠA族 | B. | 第三周期ⅠA族 | C. | 第二周期ⅦA族 | D. | 第三周期ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
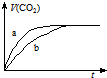 现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )
现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )| A. | 两份大理石一定有剩余 | |
| B. | 两份盐酸一定反应完全 | |
| C. | 曲线a表示的是块状大理石样品与盐酸反应 | |
| D. | 曲线b表示的是块状大理石样品与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
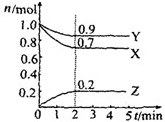 某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如右图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如右图所示,由图中数据分析:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com