
下列溶液中各离子的浓度关系不正确的是( )
A. 0.1 mol·L-1CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1
B. 浓度均为0.1 mol·L-1 Na2CO3溶液和稀盐酸等体积混合后的溶液中:
c(CO )+c(OH-)=c(H+)+c(H2CO3)
)+c(OH-)=c(H+)+c(H2CO3)
C. 25 ℃时,pH=9.4、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中:
c(Na+>c(CN-)>c(HCN)>c(OH-)
D. 3.0 L 0.1 mol·L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:
c(Na+)>c(CO )>c(HCO
)>c(HCO )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:简答题
(12分) (1)已知:蒸发1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol分子中化学键断裂时需要吸收的能量/kJ | 436 | 200 | 369 |
H2(g)+Br2(l)=2HBr(g) ΔH= 。
(2)常温下,将pH均为2的氢溴酸、乳酸(α—羟基丙酸)稀释100倍后,有一种酸的pH=4。请写出乳酸钠溶液中的水解离子方程式: 。
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示:
①根据图1和图2判断,滴定HBr溶液的曲线是 (填“图1”或“图2”);
②a= mL;
③c(Na+)=c(CH3COO-)的点是 点;
④E点对应溶液中离子浓度由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:填空题
(12分)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
下表为元素周期表的一部分,其中的字母代表相应的元素。
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| b | c | d |
|
|
| e |
|
|
|
|
|
|
|
|
|
| f |
| g |
|
|
|
|
|
|
|
|
|
|
| h | I |
|
|
|
|
|
|
|
|
(1)元素h的四价阳离子的外围电子排布式为 。
(2)元素c、d、e、f的第一电离能(I1)由小到大的顺序为 。(用相应元素的元素符号表示)
(3)表中所列的元素之间可以形成多种无机化合物和有机化合物,则它们形成的化合物之一——邻甲基苯甲醛的分子中碳原子轨道的杂化类型为 。
1 mol 苯甲醛分子中含有σ键的数目为 。
(4)元素d与e形成的化合物常用于制作 材料,其原因是 。
(5)表中有关元素形成的一种离子和单质d3互为等电子体,则该离子的化学式为 。
(6)元素I的合金可用来储存a的单质,该合金的晶胞结构如图所示,则此合金的化学式为 。
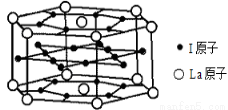
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
下列有关物质性质的应用错误的是
A.H2O2溶液有氧化性,可用于杀菌消毒
B.氯化镁是一种电解质,可用于电解法制镁
C.液氨汽化时要吸收大量的热,可用作制冷剂
D.Na2SO4能使蛋白质发生变性,可用于提纯蛋白质
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:实验题
(15分)高氯酸铜[Cu(ClO4)2·6H2O]易溶于水,120 ℃开始分解,常用于生产电极和作催化剂等。可由氯化铜通过下列反应制备:2CuCl2+2Na2CO3+H2O===Cu2(OH)2CO3↓+CO2↑+4NaCl;Cu2(OH)2CO3+4HClO4+9H2O===2Cu(ClO4)2·6H2O+CO2↑。HClO4是易挥发的发烟液体,温度高于130 ℃易爆炸。下表列出相应金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1 mol·L-1):
金属离子 | 开始沉淀 | 沉淀完全 |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 4.7 | 6.7 |
(1) 将CuCl2和Na2CO3用研钵分别研细,加入适量的沸水,搅拌,加热成蓝棕色溶液。静置、冷却、过滤、洗涤得蓝色Cu2(OH)2CO3沉淀。
① 把反应物研细的目的是____________________。
② 检验沉淀是否洗涤干净,应选用试剂是________。
(2) 向Cu2(OH)2CO3沉淀中滴加稍过量的HClO4小心搅拌,适度加热后得到蓝色Cu(ClO4)2溶液同时会产生大量的白雾。
① 大量的白雾的成分是________(填化学式)。
② 适度加热但温度不能过高的原因是____。
(3) 25 ℃时,若调节溶液pH=3,则溶液中的Fe3+的物质的量浓度为________。(已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39)
(4) 某研究小组欲用粗CuCl2固体(含Fe2+)制备纯净的无水氯化铜固体。请补充完整由粗CuCl2固体制备纯净的无水氯化铜固体的实验步骤(可选用的试剂:蒸馏水、稀盐酸、双氧水溶液和氨水):① 将粗CuCl2固体溶于蒸馏水,滴入少量的稀盐酸;② ________,过滤;③ 将滤液________,得到CuCl2·2H2O晶体;④ 将________,得到无水氯化铜固体。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述正确的是( )
A. 放电时,负极反应式为3Zn-6e-+6OH-===3Zn(OH)2
B. 放电时,正极区溶液的pH减小
C. 充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原
D. 充电时,电池的锌电极接电源的正极
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是( )
A.甲基的电子式: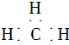
B.镁离子的结构示意图:
C.质量数为34、中子数为18的核素: S
S
D.乙酸的结构简式:
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一下学期5月段考化学必修试卷(解析版) 题型:选择题
中国是世界上最早利用天然气作燃料的国家。天然气的主要成分是
A.H2 B.CO C.CH4 D.CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com