
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如下图所示,下列结论不正确的是 ( )
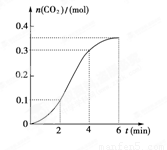
A.反应开始2 min内平均反应速率最大
B.反应速率先增大后又减小
C.反应开始4 min内温度对反应速率的影响比浓度大
D.反应在第2 min到第4 min间生成CO2的平均反应速率为 v (CO2)=0.1 mol·min-1
A
【解析】
试题分析:A、由图可知0~2min、2~4min、4~6min时间内,生成的CO2物质的量分别是0.1mol、0.3mol-0.1mol=0.2mol、0.35mol-0.3mol=0.05mol,所以反应开始2~4min内平均反应速率最大,故A错误;B、由图可知反应速率先增大后又减小,B正确;C、随反应进行氢离子浓度降低,氢离子浓度变化使反应速率降低。由图象可知,开始生成的二氧化碳的反应速率是增大,说明反应为放热反应,即反应开始4 min内温度对反应速率的影响比浓度大,故C正确;D、反应在第2 min到第4 min间生成CO2的平均反应速率为 v (CO2)= =0.1 mol·min-1,因此选项D正确,答案选A。
=0.1 mol·min-1,因此选项D正确,答案选A。
考点:考查反应速率的定量计算、外界条件对反应速率的影响以及有关图象分析等
点评:该题是中等难度的试题,主要是考查学生对反应速率含义和表示的熟悉了解程度,侧重对学生灵活运用基础知识解决实际问题的能力的培养,有利于激发学生的学习兴趣和学习积极性。


科目:高中化学 来源: 题型:

(1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则A与B共热的化学方程式为_____________________________。
(2)若A是碳化钙(CaC2),B是一种盐,A与B的溶液反应时只生成气体C、CaCO3和水;
则B的化学式为_______________;C分子是____________分子(填“极性”或“非极性”),所含共价键的类型为________________。
(3)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液,A的相对分子质量与D相同。向一定量的B溶液中逐渐加入固体粉末A,当A与B以物质的量之比3∶1反应时,生成的D的量最多。则A的化学式为______________,B的化学式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.澄清 石 灰 水 跟 稀 硝 酸 反 应 :Ca(OH)2+2H+=Ca2++2H2O
B.稀硫酸与Cu反应:2H++Cu=Cu2+ +H2↑
C.碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
D.铁粉加入AgNO3溶液中:Fe+Ag+=Fe2++Ag
查看答案和解析>>
科目:高中化学 来源:2009-2010学年河南省郑州市金水区实验中学高二(上)期中化学试卷(解析版) 题型:选择题

查看答案和解析>>
科目:高中化学 来源: 题型:
 用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是
A.OE段表示的平均速度最大
B.EF段,用盐酸表示该反应的平均反应速率为0.4mol /(L?min)
C.OE、EF、FG三段中,该反应用CO2表示的平均反应速率之比为267
D.G点表示收集的CO2的量最多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com