
 甲醇是一种优质燃料,可制作燃料电池.
甲醇是一种优质燃料,可制作燃料电池.| △c |
| △t |
| 2.25mol/L |
| 10min |
| ①-② |
| 2 |
| △H1-△H2 |
| 2 |
| △H1-△H2 |
| 2 |


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| A、480 mL |
| B、600 mL |
| C、800 mL |
| D、960 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钡与盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、溶液中,硫酸铜与氢氧化钡反应:Cu2++2OH-=Cu(OH)2↓ |
| C、向FeBr2溶液中通入少量的氯气:2Br-+Cl2=Br2+2Cl- |
| D、SO2通入足量烧碱溶液中:SO2+2OH-=SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu与FeCl3溶液的反应,既属于离子反应,又属于氧化还原反应,还属于化合反应 |
| B、CO2通入足量澄清石灰水中,反应的离子方程式为CO2+Ca2++2OH-=CaCO3↓+H2O |
| C、25℃时,c(OH-)=10-13mol/L的溶液中,HCO3-、K+、Ba2+、CH3COO-一定能够大量共存 |
| D、仅含有0.1 mol Mg2+、0.1 mol SO42-、0.1 mol Cl-、x mol Fe3+的溶液中,x=0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78g过氧化钠晶体中,含2NA个阴离子 |
| B、足量的铜与含2molH2SO4的浓硫酸充分反应,可生成NA个SO2分子 |
| C、200mL5mol?L-1Na2CO3溶液中,含NA个CO32- |
| D、3mol铁与足量的水蒸气充分反应,转移电子8NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
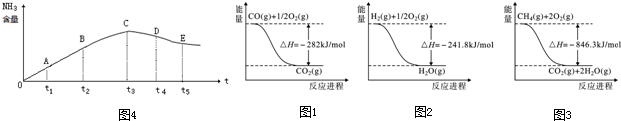

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中A~J分别代表相关反应的一种物质.已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出.
如图中A~J分别代表相关反应的一种物质.已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com