【答案】
分析:A、0.1mol/LHA溶液的pH>1说明为弱酸,0.1mol/LBOH溶液中c(OH
-)/c(H
+)=10
12,结合常温下溶液中离子积常数计算氢氧根离子浓度判断碱性强弱,来比较离子浓度大小关系;
B、醋酸为弱电解质,浓度越大,电离程度越小,pH为2和3的CH
3COOH溶液,后者电离程度大,根据含等物质的量NaOH的溶液分别用pH为2和3的CH
3COOH溶液中和,二者物质的量相等判断.C、反应计算混合后的溶液中存在的物质,结合一水合氨定量程度大于铵根离子的水解程度分析判断;
D、依据其他离子对铵根离子水解程度的影响分析判断;
解答:解:A、0.1mol/LHA溶液的pH>1说明为弱酸,0.1mol/LBOH溶液中c(OH
-)/c(H
+)=10
12,C(OH
-)?C(H
+)=10
-14,计算得到C(OH
-)=0.1mol/L,是强碱,这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为:c(B
+)>c(A
-)>c(OH
-)>c(H
+),故A错误;
B、含等物质的量NaOH的溶液分别用pH为2和3的CH
3COOH溶液中和,则有二者物质的量相等,因为所中和的氢氧化钠的物质的量是一定的,而醋酸是弱酸,醋酸为弱电解质,浓度越大,电离程度越小,pH为2和3的CH
3COOH溶液,后者电离程度大,pH为2的CH
3COOH的浓度大于pH为3的CH
3COOH溶液的浓度的10倍,
设pH为2的醋酸浓度为x,PH=3的醋酸浓度为y,则有V
a×x=V
b×y,
则
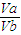
=
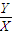
<
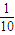
,即V
b>10V
a,故B错误;
C、0.1mol?L
-1的NH
4Cl溶液与0.05mol?L
-1的NaOH溶液等体积混合后,溶液中含有等浓度的一水合氨和氯化铵溶液,一水合氨电离程度大于铵根离子的水解,溶液中离子浓度大小为c(Cl
-)>c(NH
4+)>c(Na
+)>c(OH
-)>c(H
+),故C错误;
D、浓度相等的(NH
4)
2SO
4溶液、(NH
4)
2CO
3溶液和NH
4Cl溶液中c(NH
4+)一定是(NH
4)
2SO
4溶液、(NH
4)
2CO
3溶液大于NH
4Cl溶液,碳酸铵溶液中碳酸根离子水解促进铵根离子的水解,硫酸铵中硫酸根离子不影响,所以溶液中铵根离子浓度大小为c( NH
4Cl)<c[(NH
4)
2CO
3]<c[(NH
4)
2SO
4],故D正确;
故选 D.
点评:本题考查了酸碱混合溶液中离子浓度大小比较,弱电解质的电离平衡应用,盐类水解应用,主要是不同浓度的弱电解质溶液与碱反应的定量计算判断,综合性较强.

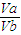 =
=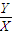 <
<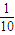 ,即Vb>10Va,故B错误;
,即Vb>10Va,故B错误;

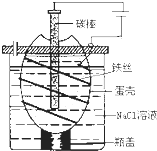 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,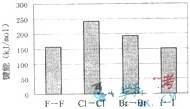 (2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
