
【题目】下列说法正确的是( )
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJmol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJmol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJmol-1
A.H2(g)的燃烧热为571.6 kJmol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) ΔH=-57.3 kJmol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJmol-1
【答案】B
【解析】
A. 根据2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJmol-1可知1mol氢气燃烧生成1mol液态水放出热量为285.8 kJ,则氢气燃烧热为285.8 kJmol1,故A错误;
B. 同质量的H2(g)和CH3OH(l)完全燃烧,设质量均为1g。根据热化学方程式,2molH2即4gH2完全燃烧放出的热量为571.6kJ,则1gH2完全燃烧放出的热量为![]() =142.9kJ。同理可计算1g甲醇完全燃烧放出的热量为 22.69kJ,所以H2(g)放出的热量多,故B正确;
=142.9kJ。同理可计算1g甲醇完全燃烧放出的热量为 22.69kJ,所以H2(g)放出的热量多,故B正确;
C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJmol-1知,生成1mol水放出57.3KJ热量,而反应H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l)生成2mol水,且生成BaSO4沉淀也有热量变化,所以反应热不是-57.3 kJmol-1,故C错误;
D. ①2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJmol-1
②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJmol-1
按盖斯定律计算①×3②得到:6H2(g)+2CO2(g)═2CH3OH(l)+2H2O(l) △H=262.8 kJmol1,则正确的热化学方程式是:3H2(g)+CO2(g)═CH3OH(l)+H2O(l) △H=131.4 kJmol1,故D错误;
故选B。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )

A.电路中的电子从负极经外电路到正极,再经过KOH溶液回到负极,形成闭合回路
B.a处通入氧气,b处通氢气
C.电池放电后,OH-的物质的量浓度减小
D.通入O2的电极发生反应:O2+4e-=2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.8.4g乙烯和丙烯混合气体中含C-H键个数为1.2NA个
B.盛有NO2的密闭容器在含有NA个氧原子,则NO2的物质的量是0.5mol
C.标准状况下,22.4L二氯甲烷的分子数为NA个
D.电解精炼铜时,若阳极质量减少64g,则阴极得电子数为2NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是( )
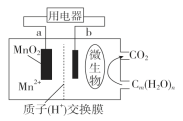
A. 电池工作时,电子由a流向b
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 正极反应式为:MnO2+4H++2e-===Mn2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的常见短周期元素,X的某种氢化物能使湿润的红色石蕊试纸变蓝.Y的一种核素质量数为18,中子数为10.在同周期元素中Z的简单离子半径最小,W的单质是良好的半导体材料。下列说法中正确的是
A. 简单气态氢化物稳定性:W >X
B. Y元素的相对原子质量为18
C. X2H4的分子中极性键和非极性键数目比为4:l
D. 电解Z的熔融氯化物可以冶炼单质Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4![]() FeSO4+H2↑的能量变化趋势如图所示:
FeSO4+H2↑的能量变化趋势如图所示:
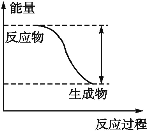
(1)该反应为____________(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率增大,下列措施可行的是____________(填字母)。
A.改铁片为铁粉B.改稀硫酸为98%的浓硫酸C.升高温度D.减小压强
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为____________(填“正”或“负”)极。铜片上产生的现象为____________,该极上发生的电极反应为____________,铁电极的电极反应为____________,外电路中电子由____________(填“正”或“负”,下同)极向____________极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
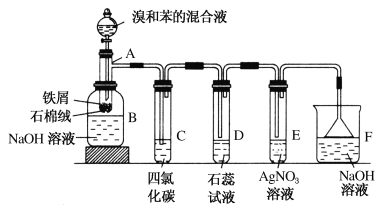
填写下列空白:
①试管A中的反应方程式为_______________。
②试管C中四氯化碳的作用是:____________。反应开始后,观察D和E两试管,看到的现象为:_________________。写出E中反应的离子方程式_____________________。
③在上述整套装置中,具有防倒吸功能的仪器有_____(填字母)。
(2)实验室制备硝基苯的主要步骤如下:
a. 配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b. 向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c. 在55~60 ℃下发生反应,直至反应结束;
d .除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;
e. 将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯。
请填写下列空白:
①制备硝基苯的反应类型是________。
②配制一定比例的浓H2SO4和浓HNO3的混合酸时,操作的注意事项是:___________。
③步骤d中洗涤、分离粗硝基苯应使用的仪器是___________________。
④步骤d中粗产品用5%NaOH溶液洗涤的目的是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是短周期主族元素,且原子序数依次增大。在短周期中A元素原子半径最小,D元素原子半径最大,B的简单氢化物的水溶液呈碱性,C、E同主族,形成的化合物为![]() 、
、![]() 。回答下列问题:
。回答下列问题:
![]() 在元素周期表中的位置为_______。
在元素周期表中的位置为_______。
![]() 比较B与C简单氢化物的热稳定性:_____>____。
比较B与C简单氢化物的热稳定性:_____>____。![]() 填化学式
填化学式![]()
![]() ,C两元素组成的化合物
,C两元素组成的化合物![]() 与水反应的化学方程式为__________
与水反应的化学方程式为__________
![]() 写出实验室制取BA3的化学方程式__________
写出实验室制取BA3的化学方程式__________
(5)实验室检验BA3的方法_________
(6)D、F的最高价氧化物的水化物酸性较强的是_________(用化学式表示)
(7)用电子式表示![]() _________
_________![]() _____________
_____________
(8)下列说法正确的是__________
A.元素F形成的单质比元素E形成的单质的熔点低
B.F和E两元素的简单氢化物受热分解,前者的分解温度高
C.![]() 通入到
通入到![]() 的溶液中出现浑浊
的溶液中出现浑浊
D.F氢化物的酸性比E氢化物的酸性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
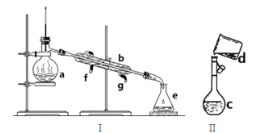
(1)写出下列仪器的名称:a._____ b.______ c.___
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是______,将仪器补充完整后进行实验的名称为___;冷凝水由___(填f或g)口通入,____口流出。现需配制250mL0.2mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com