
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向AgNO3溶液中加入过量氨水 | 由白色沉淀生成 | Ag+与NH3•H2O不能共存 |
| B | 向2ml2%的CuSO4溶液中加入0.5mol/L的NaOH溶液,震荡后低价几滴M溶液,加热 | 未出现砖红的沉淀 | M不属于醛类物质 |
| C | 向NaAlO2溶液中滴加饱和NaHCO3溶液 | 由白色沉淀生成 | 验证两者都发生了水解反应,且相互促进 |
| D | 向草酸溶液中低价几滴紫色酸性KmnO4溶液,震荡 | 溶液紫色褪去 | 草酸具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.向AgNO3溶液中滴加过量氨水,先生成AgOH后被过量的氨水溶解生成络离子;
B.可能NaOH不足,检验-CHO应在碱性条件下;
C.向NaAlO2溶液中滴加饱和NaHCO3溶液,偏铝酸根离子促进碳酸氢根离子的电离;
D.发生氧化还原反应.
解答 解:A.向AgNO3溶液中滴加过量氨水,先生成AgOH后被过量的氨水溶解生成络离子,得不到白色沉淀,故A错误;
B.加入的NaOH不足,不能与葡萄糖反应生成砖红色沉淀,故B错误;
C.向NaAlO2溶液中滴加饱和NaHCO3溶液,偏铝酸根离子促进碳酸氢根离子电离且和氢离子结合生成氢氧化铝白色沉淀,生成沉淀与水解无关,故C错误;
D.发生氧化还原反应,KMnO4溶液紫红色褪去,体现草酸的还原性,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,题目难度中等,试题涉及物质间的反应、离子检验,还原性等知识,把握反应原理及反应与现象的关系为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析.


科目:高中化学 来源: 题型:解答题
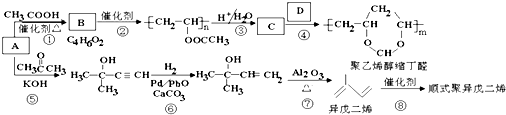
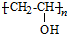 、CH3CH2CH2CHO.
、CH3CH2CH2CHO.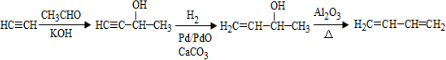 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl与浓H2SO4混合共热,生成的气体用碱石灰进行干燥 | |
| B. | N2+3H2$?_{高温、高压}^{催化剂}$2NH3,用烧碱进行干燥 | |
| C. | 加热浓氨水,气体用碱石灰干燥 | |
| D. | 加热NH4HCO3,气体用P2O5干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z | ||
| X | W |
| A. | 原子半径:X>Z>W | |
| B. | 气态氢化物的稳定性:Y>Z>W | |
| C. | Z、W均可形成含Y元素的离子化合物 | |
| D. | 最高价氧化物对应水化物的酸性:Y>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
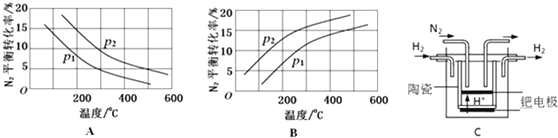
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有些食物中铁元素含量非常丰富,其中非血红素铁是其存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
有些食物中铁元素含量非常丰富,其中非血红素铁是其存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
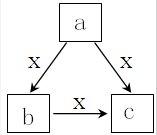 X为一种常见气体(常温下),a,b,c是中学化学常见物质,均由常见元素组成,转化关系如图所示,下列说法不正确的是( )
X为一种常见气体(常温下),a,b,c是中学化学常见物质,均由常见元素组成,转化关系如图所示,下列说法不正确的是( )| A. | 若a、b、c焰色反应均呈黄色,其水溶液均为碱性,则a中可能既含有离子键又含有共价键 | |
| B. | 若X为O2,a为一种固态单质,则c可能为CO2或SO2 | |
| C. | 若b为固态非金属单质,X为气体单质,且b与X所含元素同主族,则a→b、b→c、a→c的反应均为氧化还原反应 | |
| D. | 若a、b、c均含有同一种非金属,且X的水溶液呈碱性,则c可能受热易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 一定条件下6.4g S02与足量氧气反应生成S03,转移电子数小于0.2 NA | |
| C. | lmol羟基(一OH)与17gNH3所含电子数都为NA | |
| D. | 适量铜粉溶解于1 L 0.5mol/L稀硝酸中,当生成2.24 L NO时,溶液中氮原子数0.4 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com