
【题目】标准状况下,等体积的NH3和CH4两种气体,下列有关说法错误的是( )
A.所含分子数目相同
B.所含氢原子物质的量之比为3:4
C.质量之比为16:17
D.密度之比为17:16
【答案】C
【解析】解:标况下,气体摩尔体积为22.4L/mol.
A、根据N=nNA= ![]() 知,相同条件下,气体摩尔体积相同,气体的分子数与气体的体积成正比,所以相同体积的氨气和甲烷,所含分子数相同,故A正确;
知,相同条件下,气体摩尔体积相同,气体的分子数与气体的体积成正比,所以相同体积的氨气和甲烷,所含分子数相同,故A正确;
B、相同条件下,等体积的氨气和甲烷的物质的量相同,一个氨气分子中含有3个H,一个甲烷分子中含有4个H,所以所含氢原子物质的量之比为3:4,故B正确;
C、根据m= ![]() 知,相同条件下,等体积的氨气和甲烷,其质量与相对分子质量成正比,所以其质量之比=17:16,故C错误;
知,相同条件下,等体积的氨气和甲烷,其质量与相对分子质量成正比,所以其质量之比=17:16,故C错误;
D、根据 ![]() 知,相同条件下,气体摩尔体积相同,气体的密度与相对分子质量成之比,所以其密度之比=1,7:16,故D正确.
知,相同条件下,气体摩尔体积相同,气体的密度与相对分子质量成之比,所以其密度之比=1,7:16,故D正确.
故选C.


科目:高中化学 来源: 题型:
【题目】在CH3COOH溶液中存在如下平衡:CH3COOHCH3COO-+H+。加入少量下列物质或采取下述方法,能使平衡逆向移动的是( )
A. 加水 B. 升温
C. CH3COONa固体 D. NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向BaCl2溶液中通入SO2将溶液分置于两支试管中,向一份中加入NaOH溶液,出现白色沉淀A,另一份通入少量Cl2 , 产生白色沉淀B,试回答下列问题:
(1)若不考虑SO2与水的反应向BaCl2溶液中通入SO2无明显现象,“无明显现象”可能是“不反应”,也可能是“反应但无现象”.此处应为 , 原因是 .
(2)沉淀A的化学式为 , 该沉淀能否溶于稀盐酸? .
(3)写出生成沉淀B的离子方程式: .
(4)生成2.33 g沉淀B,需消耗标准状况下的Cl2mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气及其相关产品是基本化工原料,在化工领域中具有重要的作用。
(1)以铁为催化剂,0.6mol氮气和1.8mol氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,20min后达到平衡,氮气的物质的量为0.3mol。
①在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,体系达到平衡时N2的总转化率为38.2%,请画出从第25min起H2的物质的量浓度随时间变化的曲线_____。
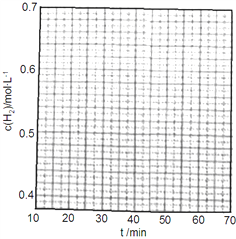
②该反应体系未达到平衡时,催化剂对逆反应速率的影响是_____(填增大、减少或不变)。
(2)①N2H4是一种高能燃料,有强还原性,可通过NH3和NaClO反应制得,写出该制备反应的化学方程式______________________。
②N2H4的水溶液呈弱碱性,室温下其电离常数K1=1.0×10-6,则0.01 mol·L-1 N2H4水溶液的pH等于__________(忽略N2H4的二级电离和H2O的电离)。
③已知298K和101KPa条件下:
N2(g)+3H2(g)=2NH3(g) ΔH1
2H2(g)+O2(g)=2H2O(l) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(I) ΔH4
则N2H4(l)的标准燃烧热ΔH=_______。
(3)科学家改进了NO2转化为HNO3的工艺(如虚框所示),在较高的操作压力下,提高N2O4/H2O的质量比和O2的用量,能制备出高浓度的硝酸。
![]()
实际操作中,应控制N2O4/H2O质量比高于5.11,对此请给出合理解释______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海洋植物中提取碘的流程如下: ![]()
某化学兴趣小组将上述流程②③设计成如图所示实验.
已知:②中发生反应的化学方程式为Cl2+2KI═2KCl+I2 .
(1)写出提取流程中①③实验操作的名称:① , ③ .
(2)四氯化碳是无色、密度比水大的液体.F中下层液体的颜色为色,上层液体中溶质的主要成分为 .
(3)从F中得到碘单质还需进行的操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是重要的化工原料。下列有关苯乙烯的说法错误的是( )
A.能与溴水发生加成反应
B.能使酸性高锰酸钾溶液褪色
C.与氯化氢反应可以生成氯代苯乙烯
D.在催化剂存在下可以制得聚苯乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质按酸、碱、盐分类排列,正确的是
A. 硝酸、生石灰、石灰石 B. 醋酸、纯碱、食盐
C. 盐酸、乙醇、硝酸钾 D. 硫酸、烧碱、碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中正确的是( )
A.HF溶于少量水中:HF+H2OF﹣+H3O+
B.H2S溶于水:H2S2H++S2﹣
C.Na2HPO4溶于水:Na2HPO4═2Na++H++PO43﹣
D.NaHSO4熔融:NaHSO4═Na++H++SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向足量H2SO4溶液中加入100 mL 0.4 mol·L-1Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
A. Ba2+(aq)+SO42-(aq) =BaSO4(s)ΔH=-2.92 kJ·mol-1
B. Ba2+(aq)+SO42-(aq) =BaSO4(s)ΔH=-18 kJ·mol-1
C. Ba2+(aq)+SO42-(aq) =BaSO4(s)ΔH=-73 kJ·mol-1
D. Ba2+(aq)+SO42-(aq)=BaSO4(s)ΔH=-0.72 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com