
| A. | 含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32- | |
| B. | 含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+ | |
| C. | 含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3 | |
| D. | 含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ |
分析 A.用假设法判断,H+最先与AlO2-反应,生成氢氧化铝,而氢氧化铝与溶液中OH-反应生成AlO2-;
B.同一还原剂与不同具有氧化性的物质反应时,先与氧化性强的物质反应;
C.氢氧化钡先发生反应,因为碳酸钾与氢氧化钡不能共存;
D.离子还原性I->Fe2+>Br-,同一氧化剂与不同具有还原性的物质反应时,先与还原性强的物质反应.
解答 解:A.若H+最先与AlO2-反应,生成氢氧化铝,而氢氧化铝与溶液中OH-反应生成AlO2-,反应顺序为OH-、AlO2-、CO32-,故A错误;
B.氧化性顺序:Ag+>Cu2+>H+>Fe2+,锌粉先与氧化性强的反应,反应顺序为Ag+、Cu2+、H+、Fe2+,故B正确;
C.氢氧化钡先发生反应,因为碳酸钾与氢氧化钡不能共存,故C错误;
D.离子还原性I->Fe2+>Br-,氯气先与还原性强的反应,氯气的氧化顺序是I-、Fe2+、Br-,因为2Fe2++Br2=2Fe3++2Br-,故D错误;
故选B.
点评 本题考查离子反应的先后顺序等,题目难度中等,明确反应发生的本质与物质性质是关键,注意掌握元素化合物的性质,是对学生综合能力的考查,试题培养了学生的灵活应用能力.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题
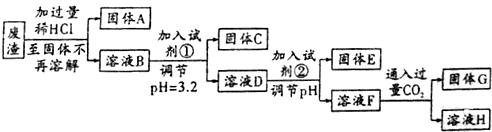
| 离子 | 以氢氧化物形式完全沉淀时所需pH | 氢氧化物沉淀完全溶解时所需pH |
| Fe3+ | 3.2 | |
| A13+ | 5.3 | 11.9 |
| Mg2+ | 12.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
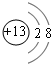 、
、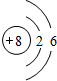 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b=a+34 | B. | a=b-11 | C. | b=a+25 | D. | a=b-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙两试管都有白色沉淀生成 | |
| B. | 甲、乙两试管都没有白色沉淀生成 | |
| C. | 甲试管没有白色沉淀生成而乙试管有 | |
| D. | 甲试管有白色沉淀生成而乙试管没有 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用).
实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用).| 液体试剂 | 固体药品 |
| 稀硫酸、稀盐酸、稀硝酸、NaOH溶液、浓氨水、5%H2O2溶液、浓盐酸、饱和食盐水 | CaCO3、CaO、MnO2、KMnO4、 碱石灰、Cu、Zn、Na2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属的用途 | 对应的金属物理性质 |
| 金可制成比纸还薄的金箔 | ③ |
| 用铁、铝等做炊具 | ② |
| 用铜制作印刷电路 | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;由A和B形成的原子个数为1:1的化合物中阴阳离子个数比为1:1.
;由A和B形成的原子个数为1:1的化合物中阴阳离子个数比为1:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com