
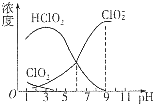
 亚氯酸钠(NaClO2)是一种高效漂白剂.在NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列说法错误的是( )
亚氯酸钠(NaClO2)是一种高效漂白剂.在NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列说法错误的是( )| A. | 亚氯酸钠溶液在碱性条件下较稳定 | |
| B. | 25℃时,HClO2的电离平衡常数的数值Ka=10-6 | |
| C. | 使用该漂白剂的最佳pH约为4 | |
| D. | 25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合(pH=5.1),则混合溶液中有c(HClO2)+c(H+)=c(ClO${\;}_{2}^{-}$)+c(OH-) |
分析 A.由图可以得出:碱性条件下ClO2-浓度高;
B.HClO2的电离平衡常数K=$\frac{C({H}^{+})C(Cl{{O}_{2}}^{-})}{C(HCl{O}_{2})}$结合图示数据来计算;
C.根据题意:HClO2和ClO2都具有漂白作用,结合图中HClO2和ClO2的浓度大小来确定使用该漂白剂的最佳pH;
D.依据电中性原则得出:c(H+)+c(Na+)=c(ClO2-)+c(OH-),依据物料守恒得出:2c(Na+)=c(ClO2-)+c(HClO2),据此解答即可.
解答 解:A、由图可以得出:碱性条件下ClO2-浓度高,即在碱性条件下亚氯酸钠较稳定,故A正确;
B.HClO2的电离平衡常数K=$\frac{C({H}^{+})C(Cl{{O}_{2}}^{-})}{C(HCl{O}_{2})}$=10-3×10-3=10-6,故B正确;
C.HClO2和ClO2都具有漂白作用,结合图中HClO2和ClO2的浓度越大即为使用该漂白剂的最佳pH约为4,故C正确;
D.依据电中性原则得出:c(H+)+c(Na+)=c(ClO2-)+c(OH-) ①,依据物料守恒得出:2c(Na+)=c(ClO2-)+c(HClO2) ②,联立①②消去钠离子:c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-),故D错误,
故选D.
点评 本题考查了酸碱混合的定性判断,题目难度中等,正确分析、理解题中信息及图象数据是解答本题关键,注意明确溶液酸碱性与溶液pH的关系.


 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
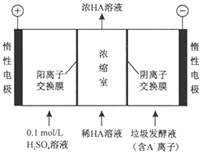 对生活污水进行处理是防止水体污染、改善水质的主要措施.电渗析法处理厨房垃圾发酵液(含污染物乳酸跟离子)同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子).下列叙述中正确的是( )
对生活污水进行处理是防止水体污染、改善水质的主要措施.电渗析法处理厨房垃圾发酵液(含污染物乳酸跟离子)同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子).下列叙述中正确的是( )| A. | 阴极区溶液的pH变小 | |
| B. | 阳极的电极反应式为2H2O-4e-═4H++O2↑ | |
| C. | 通过一段时间后浓缩至水的量减少,导致乳酸溶液浓度上升 | |
| D. | 若阳、阴离子交换膜调换位置,与如图可以达到相同的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g NO2和N2O4以任意比混合,所得混合气体中氧原子数为NA | |
| B. | 标准状况下,含2NA个单键的甲醛分子所占的体积约为22.4 L | |
| C. | 1mol Fe 与一定量的硝酸反应,转移的电子数为0.2NA~0.3NA | |
| D. | 1mol N2和3mol H2混合,在密闭容器中充分反应后,容器内的N-H键数可能等于5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
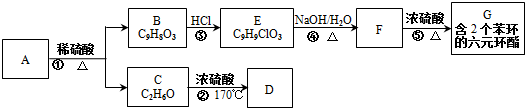
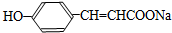 .
.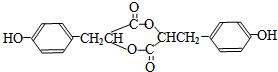 .
.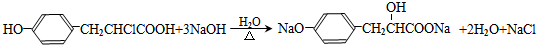 :反应①:
:反应①: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤②的白色沉淀可能为BaSO4和BaCO3 | |
| B. | 若该溶液焰色反应呈紫色,则该溶液一定有6种离子组成 | |
| C. | 步骤①中可以确定Fe2+、NO3-的存在,不能确定其它离子的存在 | |
| D. | 溶液中难以确定Al3+的存在与否 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | T℃时,pH=6的纯水中,含1×10-6NA个OH- | |
| B. | 标准状况下,1 L pH=13的氢氧化钡溶液中n(OH-)为0.1NA | |
| C. | 室温下,14.0 g乙烯和丁烯的混合气体中含有的C-H键数目为2.0NA | |
| D. | 0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: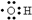 | B. | 淀粉和纤维素的实验式:CH2O | ||
| C. | CH4分子的球棍模型: | D. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com