

| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
| A、标准状况下2.24LCO2通入1mol?L-1100mL氢氧化钠溶液中:CO2+OH-=HCO3- |
| B、硝酸铝溶液中加入过量氨水:Al3-+4NH3?H2O=AlO2-+4 NH4++2H2O |
| C、Na2S水解:S2-+2 H2O?H2S+2OH- |
| D、等物质的量的NH4HCO3与NaOH在溶液中反应:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
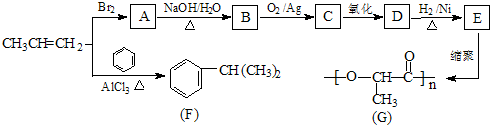
查看答案和解析>>
科目:高中化学 来源: 题型:
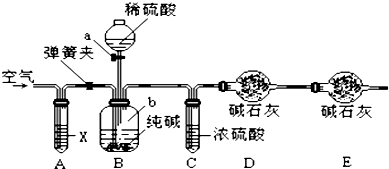
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
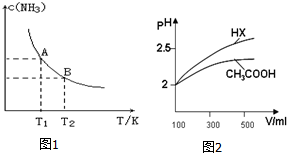 (1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g).若已知:
(1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g).若已知:查看答案和解析>>
科目:高中化学 来源: 题型:
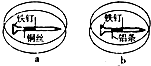 如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和
如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和| A、a中铁钉发生还原反应 |
| B、b中铁钉附近呈现红色 |
| C、a中铜丝附近呈现蓝色 |
| D、b中铝条附近有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
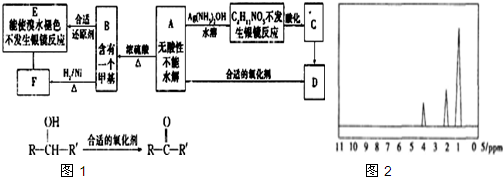
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com