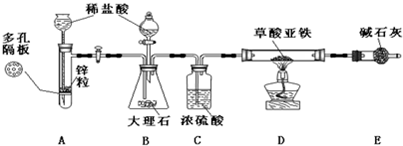
草酸亚铁(FeC
2O
4?2H
2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产.已知:CO能与氯化钯(PdCl
2)溶液反应生成黑色的钯粉.回答下列问题:
Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究.
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有
.
(2)探究分解得到的固体产物中铁元素的存在形式.
①提出假设
假设1:
; 假设2:FeO; 假设3:FeO和Fe混合物
②设计实验方案证明假设3.
限选试剂:1.0mol?L
-1盐酸、3% H
2O
2、0.1mol?L
-1CuSO
4、20% KSCN、蒸馏水.
| 实验步骤 |
现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡 |
若溶液颜色明显改变,且有 生成,则证明有铁单质存在 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 |
|
| 步骤3:取步骤2得到的少量固体与试管中,滴加
|
|
Ⅱ:某草酸亚铁样品中含有少量草酸.现用滴定法测定该样品中FeC
2O
4的含量.滴定反应是:5Fe
2++5C
2O
42-+3MnO
4-+24H
+=5Fe
3++10CO
2↑+3Mn
2++12H
2O 实验方案设计为:
①将准确称量的0.20g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol/L的H
2SO
4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V
1 mL
②向上述滴定混合液中加入适量的Zn粉和过量的2mol/L的H
2SO
4溶液,煮沸5~8min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红.将滤液过滤至另一个锥形瓶中,继续用0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V
2 mL
③重复以上实验1~2次
若某小组的一次测定数据记录如下:V
1=18.90mL,V
2=6.20mL.根据数据计算0.20g 样品中:n(Fe
2+)=
; n(C
2O
42-)=
;FeC
2O
4 的质量分数为
(精确到0.01%)



 阅读快车系列答案
阅读快车系列答案