
能正确表示下列反应的离子方程式是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+4H2O
C.磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:
2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源:2014-2015学年甘肃省天水市高一上学期期中考试化学试卷(解析版) 题型:选择题
将3.22克Na2SO4 ·10H2O 溶于水中,要使Na+离子数目与水分子数目之比为1:100,则加入水的质量为( )克
A.18 B.36 C 34.2 D.37.8
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃天水市高二上第一阶段考试卷化学试卷(解析版) 题型:选择题
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是 ( )

A.反应开始到10s,用Z表示的反应速率0.158mol/(L·s)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)  Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃天水市高二上第一阶段考试卷化学试卷(解析版) 题型:选择题
改变反应条件使化学平衡向正反应方向移动时,下列变化中正确的是
A.生成物浓度一定增大 B.生成物的物质的量分数一定增大
C.反应物的转化率一定增大 D.某生成物的产率可能提高
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南长沙市高三上学期第二次月考化学试卷(解析版) 题型:选择题
将35.8 g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44 LNO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为
A.66.4 g B.50.8 g C 44.8g D. 39.2 g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南长沙市高三上学期第二次月考化学试卷(解析版) 题型:选择题
用图中所示的装置进行实验,实验现象与预测不一致的是
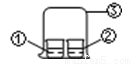
| ①中的物质 | ②中的物质 | 预测现象 |
A | 浓氨水 | FeCl3溶液 | ②中有红褐色沉淀 |
B | 浓氨水 | 浓盐酸 | ③中有白烟 |
C | 浓硝酸 | 淀粉KI溶液 | ②中溶液为蓝色 |
D | 饱和亚硫酸溶液 | 蓝色石蕊试液 | ②中溶液先变红又褪色 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南邵阳县石齐学校高二上第一次月考化学(理)试卷(解析版) 题型:填空题
某温度时,在10 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 2.00 | 0.00 |
1 | 0.90 | 1.80 | 0.20 |
3 | 0.75 | 1.50 | 0.50 |
5 | 0.65 | 1.30 | 0.70 |
9 | 0.55 | 1.10 | 0.90 |
10 | 0.55 | 1.10 | 0.90 |
14 | 0.55 | 1.10 | 0.90 |
(1) 体系中发生反应的化学方程式是____________;
(2) 计算该反应在0~3 min时间内产物Z的平均反应速率:________;
(3) 该反应达到平衡时反应物X的转化率α等于________;
(4) 如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1所对应的实验条件改变是:______ ___ ___。
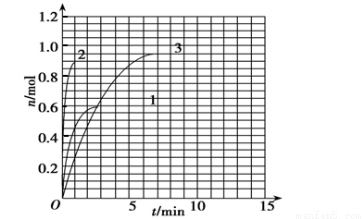
(5)如果起始加入X、Y、Z的物质的量分别为2.00 mol、4.00 mol和0 mol,在原温度下达平衡时,X的转化率为α!,则α! α(填 < > =)。
(6)如果在原温度下起始加入X、Y、Z的物质的量分别为1.00 mol、1.00 mol和1.00 mol,此时可逆反应的反应速率:?(正) ?(逆)(填 < > =)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南邵阳县石齐学校高二上第一次月考化学(理)试卷(解析版) 题型:选择题
对于可逆反应:2A(g)+B(g)  2C(g) △H<0,下列图象正确的是( )
2C(g) △H<0,下列图象正确的是( )

查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第二次月考化学试卷(解析版) 题型:实验题
(14分)硫代硫酸钠(Na2S2O3)是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.【查阅资料】
(1)硫代硫酸钠(Na2S2O3)易溶于水,在中性或碱性环境中稳定,受热、遇酸易分解。
(2)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(3)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3(反应方程式为:2Na2S+Na2CO3+ 4SO2===3Na2S2O3+CO2),所得产品常含有少量Na2SO3和Na2SO4。
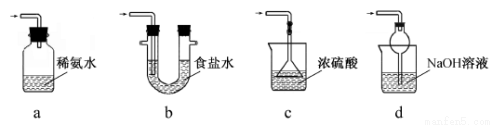
Ⅱ.【制备产品】实验装置如图所示:

请回答下列问题:
(1)实验步骤:检查装置气密性后,向三颈瓶c中加入Na2CO3和Na2S的混合溶液,再将分液漏斗a中液体滴加到烧瓶b中加热发生反应产生SO2,请写出b中发生反应的化学方程式______________________。待Na2S和Na2CO3完全消耗后,结束反应。过滤c中的混合物,滤液经____________________(填写操作名称)、过滤、洗涤、干燥、得到产品。
(2) 装置A用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是____________________。
III.【测定产品纯度】
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O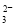 +I2===S4O
+I2===S4O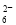 +2I-(忽略Na2SO3与I2反应)
+2I-(忽略Na2SO3与I2反应)
(4)滴定至终点时,溶液颜色的变化:_________________________________。
(5)滴定起始和终点的液面位置如图,则产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
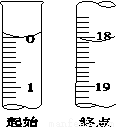
IV.【探究与反思】
(6)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_______________________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com