
| A. | 将纯水加热至较高温度,Kw变大、pH变小、呈酸性 | |
| B. | 保存FeSO4溶液时,应在其中加入稀HNO3以抑制Fe2+水解 | |
| C. | 向0.1 mol•L-1 氨水中加入少量水,pH减小,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| D. | AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
分析 A.依据纯水是呈中性的,一定温度下水中的氢离子浓度和氢氧根离子浓度乘积是常数,温度升高促进水的电离,水的离子积增大分析;
B.稀硝酸具有强氧化性能氧化亚铁离子;
C.氨水中一水合氨存在电离平衡,加水稀释促进电离,溶液中氢离子浓度减小,氢氧根离子浓度增大;
D.氯化铝溶液中氯化铝水解生成氢氧化铝和氯化氢,加热蒸发氯化氢挥发促进水解平衡正向进行,得到氢氧化铝,灼烧得到氧化铝;
解答 解:A.水的电离是吸热过程,将纯水加热至较高温度,促进了水的电离,生成的氢离子和氢氧根离子浓度增大,pH减小,水的离子积增大,水的离子积只随温度的改变而改变,但电离出的氢离子和氢氧根离子相等,所以水仍是中性,故A错误;
B.稀硝酸具有强氧化性能氧化亚铁离子,保存FeSO4溶液时,应在其中加入稀硫酸以抑制Fe2+水解,故B错误;
C.氨水中一水合氨存在电离平衡,加水稀释促进电离,溶液中氢离子浓度减小,PH增大,氢氧根离子浓度增大,一水合氨浓度减小,则比值增大,故C正确;
D.氯化铝溶液中氯化铝水解生成氢氧化铝和氯化氢,AlCl3+3H2O?Al(OH)3+3HCl,加热蒸发氯化氢挥发促进水解平衡正向进行,得到氢氧化铝,灼烧得到氧化铝,故D错误;
故选C.
点评 本题考查了水电离平衡、弱电解质电离平衡影响因素分析,盐类水解原理,氧化还原反应等知识点,掌握基础注意隐含条件的分析判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 是易导电的银白色金属 | B. | Tl(OH)3是两性氢氧化物 | ||
| C. | Tl3+能形成+3价的化合物 | D. | 单质能与稀硝酸反应生成硝酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的一种核素的原子核中没有中子 |
| Y | Y原子的核外电子占据4个原子轨道 |
| Z | Z的气态氢化物能使湿润的红色石蕊试纸变蓝 |
| R | R是地壳中含量最高的元素 |
| M | M的单质与冷水剧烈反应,生成的强碱中含有电子数相同的阴阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
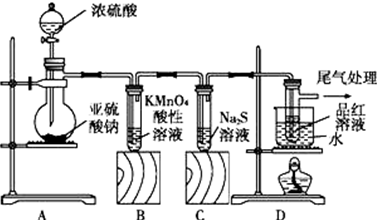
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,其中含有的化学键是离子键、共价键.
,其中含有的化学键是离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
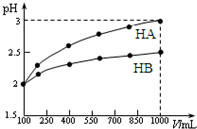 已知100mL pH=2的两种一元酸HA和HB,稀释过程中pH与溶液体积的关系如图所示.
已知100mL pH=2的两种一元酸HA和HB,稀释过程中pH与溶液体积的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
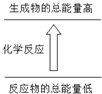 下列变化符合图示的是( )
下列变化符合图示的是( )| A. | ②⑥⑦ | B. | ②⑤⑦ | C. | ①②⑤⑥⑦ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
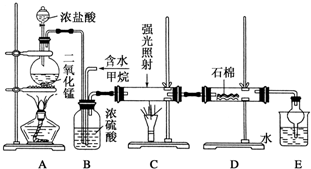
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
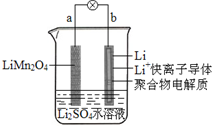
| A. | a为电池的正极 | B. | 放电时,电子由b极流向a极 | ||
| C. | 充电时,a极发生还原反应 | D. | 放电时,溶液中的Li+从b向a迁移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com