
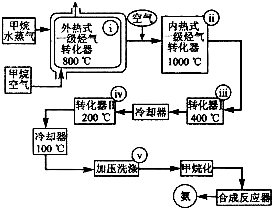
 某工厂以天然气、水蒸气和空气为原料和能源合成氨的流程如图.该流程中外热式一级烃转化器系指以CH4为燃料在烃气转化器外面加热使之维持800℃高温的工业装置.内热式一级烃气转 化器系指以H2在装置内燃烧为能量维护一 级烃气转化器所生成的CO与H20(g)反应 生成C02和H2所需1000℃高温的装置.
某工厂以天然气、水蒸气和空气为原料和能源合成氨的流程如图.该流程中外热式一级烃转化器系指以CH4为燃料在烃气转化器外面加热使之维持800℃高温的工业装置.内热式一级烃气转 化器系指以H2在装置内燃烧为能量维护一 级烃气转化器所生成的CO与H20(g)反应 生成C02和H2所需1000℃高温的装置.

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
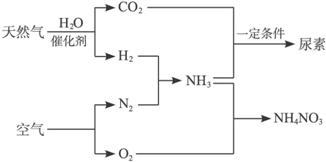
某工厂以标准状况下的含CH4 89.6%的天然气
(1)合成氨生产过程中氨的产率为60%,假设其他各步反应均完全且不考虑副反应,求
(2)为使硝酸生产过程中不再补充空气,假设各步反应均完全且氨中氮元素全部转化为HNO3,空气中氧气的体积分数设为20%,求由氨气和空气组成的原料气中(不包含被硝酸吸收的氨气)氨气与空气的体积比。
(3)实际生产中,若氨的产率为60%,硝酸的产率为80%,求
(注:产率=![]() ×100%)
×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
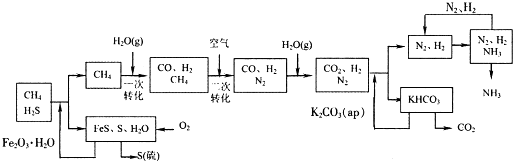
25.以天然气为原料合成氨是新的生产氮肥的方法,它具有污染小、成本低等诸多特点,其过程大体如下:

某工厂以标准状况下的含CH4 89.6%的天然气100 m3为原料经过上述过程,生产尿素和硝酸铵。
⑴ 合成氨生产过程中氨的产率为60%,假设其它各步反应均完全且不考虑副反应,求100 m3的天然气可生产尿素的质量。
⑵ 为使硝酸生产过程中不再补充空气,假设各步反应均完全且氨中氮元素全部转化为HNO3,空气中氧气的体积分数设为20%,求由氨气和空气组成的原料气中 (不包含被硝酸吸收的氨气)氨气与空气的体积比。
⑶ 实际生产中,若氨的产率为60%,硝酸的产率为80%,求100 m3的天然气最多可生产硝酸铵的质量。
(注:产率=×100%)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:填空题
某工厂以天然气、水蒸气和空气为原料和能源合成氨的流程如右图:
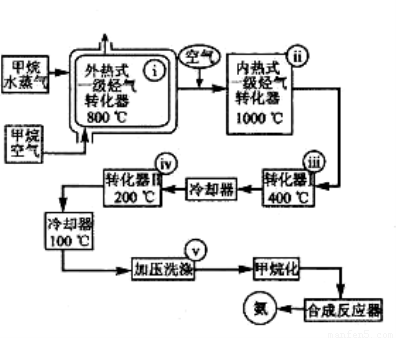
该流程中外热式一级烃转化器系指以 CH4为燃料在烃气转化器外面加热使之维持 8000C高温的工业装置。内热式一级烃气转化器系指以H2在装置内燃烧为能量维护一级烃气转化器所生成的CO与H2O(g)反应生成CO2和H2所需10000C高温的装置。在编号为i-v的反应器中发生如下反应:
A.CH4+2O2 =CO2 +2H2OB.CH4+H2O(g)=CO +3H2
C.2CH4+3H2O(g)=CO + CO2 +7H2??? ?? D.K2CO3+CO2 +H2O=2KHCO3
E.CO+ H2O(g) CO2 + H2 ΔH<0 ??? F.2H2 +O2=2H2O
CO2 + H2 ΔH<0 ??? F.2H2 +O2=2H2O
(1)反应A发生在编号为______的反应器中,它的作用是_______________________________。
(2)反应F发生在编号为____________的反应器中。
(3)反应D的作用是____________。
(4)属于制备合成氨原料气的反应有______(填化学方程式编号)。
(5)为什么转化反应要分两步——第一步在4000C时进行,第二步在200 0C时进行?
________________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com