
| 滴定次数 | ( | ( | |||
| ( | ( | ( | 平均值 | ||
| 1 | 10.00 | ||||
| 2 | 10.00 | ||||
| 3 | 10.00 | ||||
| 0.0001mol |
| 0.01L |
| 滴定 次数 | 待测溶液 体积(mL) | 标准Na2S2O3溶液体积(mL) | |||
| 滴定前 刻度 | 滴定后 刻度 | 实际体积 | 平均值 | ||
| 1 | |||||
| 2 | |||||


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
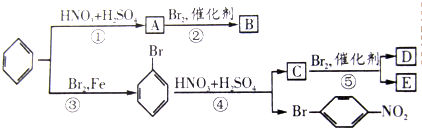
查看答案和解析>>
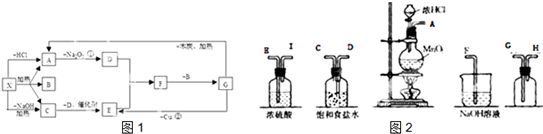
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
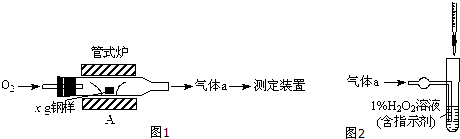
科目:高中化学 来源: 题型:
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 导管及仪器 |  |  | 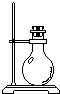 | 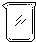 |  | 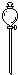 |
| 每个橡皮塞上都打了两个孔 | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试验序号 | 实 验 步 骤 | 实 验 现 象 | 结 论 |
| ① | 取少量该焰火原料加入冷水 | 无明显现象 | 不含有Li、Na等活泼金属 |
| ② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体 |
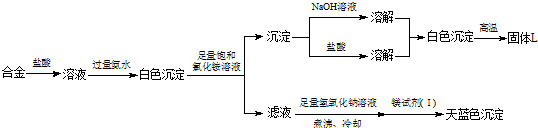
 问题讨论:
问题讨论:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应 |
| B、蔗糖和麦芽糖的水解产物都是葡萄糖 |
| C、石油经过分馏得到的各种产物是不同温度范围内的混合物 |
| D、苯和苯乙烯的最简式相同,是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 0.180 | 0.164 | 0.152 | 0.144 | 0.140 | 0.140 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com