
(1)0.1mol/L Na2CO3溶液呈 (填“酸性”、“碱性”或“中性”),其原因是 (用离子方程式表示)
(2)氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的负极的电极反应式 。
(3)某温度下的水溶液中,c(H+)=10-xmol/L,
c(OH-)=10-y mol/L。x与y的关系如右图所示:

该温度下水的离子积为 ;该温度下0.01 mol/L NaOH溶液的pH为 。
(4)如右图装置,已知两电极上发生的电极反应分别为:a极:Cu2++2e-= Cu
b极:Fe-2e-= Fe2+
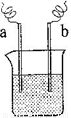
该装置中原电解质溶液一定含有 (填序号)
A. Cu2+ B.Na+ C.Fe2+ D. Ag+
(5)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s)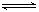 Ba 2+ (aq)+ SO42-(aq) 25℃
时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到
mol·L一1
Ba 2+ (aq)+ SO42-(aq) 25℃
时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到
mol·L一1
(1)碱性 CO32-+H2O HCO3-+OH-
HCO3-+OH-
(2)负极:2H2 + 4OH- - 4 e- = 4H2O
(3)(1)1×10-12 10
(4)A
(5)1.1×10-9 ;
【解析】(1)碳酸钠属于强碱弱酸盐,CO32-水解显碱性。
(2)在氢氧燃料电池中,负极通入氢气,失去电子被氧化,发生氧化反应。
(3)由图像可知,当x等于4时,y等于8,所以该温度下水的离子积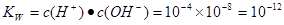 。0.01 mol/L NaOH溶液中c(OH-)=0.01mol/L,所以改温度下溶液中c(H+)=10-10mol/L,故pH等于10.
。0.01 mol/L NaOH溶液中c(OH-)=0.01mol/L,所以改温度下溶液中c(H+)=10-10mol/L,故pH等于10.
(4)在原电池中负极失去电子,发生氧化反应,正极得到电子发生还原反应。根据所给的电极反应式可知,铁作负极,溶液中的铜离子在正极上得到电子,所以答案是A。
(5)在0.1 mol·L一1硫酸溶液中,c(SO42-)是0.1 mol·L一1,根据溶度积常数的概念可知钡离子的最大浓度为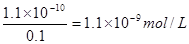 .
.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:阅读理解
 通过实验测定反应速率的方法有多种,为证明化学反应速率与反应的浓度有关.有同学设计如下实验:
通过实验测定反应速率的方法有多种,为证明化学反应速率与反应的浓度有关.有同学设计如下实验:| 序号 | Na2S2O3溶液 | 稀H2SO4 | 出现混浊时间 | ||
| 浓度 | 用量 | 浓度 | 用量 | ||
| (1) | 0.1mol?L-1 | 10mL | 0.1mol?L-1 | 10mL | t1 |
| (2) | 0.1mol?L-1 | 10mL+5mL 水 | 0.1mol?L-1 | 10mL | t2 |
| (3) | 0.1mol?L-1 | 10mL | 0.1mol?L-1 | 5mL+5mL水 | t3 |
| (4) | 0.1mol?L-1 | 5mL | 0.1mol?L-1 | 5mL | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组实验中,反应最快的是( )
| |||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com