

分析 (1)泡腾片成份中有柠檬酸和碳酸氢钠,两者反应生成二氧化碳气体,所以有大量气泡产生;
(2)配成100mL溶液,需用100ml的容量瓶;
(3)因为精确度达0.01ml,所以步骤2中准确量取出10.00mL酸性溶液用移液管或者酸性滴定管;滴定管刻度值从上到下刻度逐渐增大,滴定前液面处的读数是V1ml,滴定后液面处的读数是V2ml,消耗溶液的体积为(V2-V1)mL,而V1=2.4ml,而V2=27.4ml,所以消耗溶液的体积为27.4ml-2.4ml=25ml,根据关系式C6H8O6+I2═C6H6O6+2HI,计算维生素C的质量;
(4)应根据维生素C(C6H8O6)具有强还原性,可能极易被空气中的氧气氧化,还可能与碘水发生氧化还原反应.
解答 解:(1)泡腾片成份中有柠檬酸和碳酸氢钠,两者反应生成二氧化碳气体,所以有大量气泡产生,故答案为:柠檬酸与碳酸氢钠反应产生CO2;
(2)配成100mL溶液,需用100ml的容量瓶,故答案为:100 ml容量瓶;
(3)步骤2中准确量取出10.00mL酸性溶液用移液管或者酸性滴定管,滴定管刻度值从上到下刻度逐渐增大,滴定前液面处的读数是V1ml,滴定后液面处的读数是V2ml,消耗溶液的体积为(V2-V1)mL,而V1=2.4ml,而V2=27.4ml,所以消耗溶液的体积为27.4ml-2.4ml=25ml,
根据关系式C6H8O6+I2═C6H6O6+2HI,
维生素C的质量25ml×2.00×10-3mol•L-1×10-3L/mL×180g/mol═5×10-5mol×180g/mol=9mg,所以每片维C泡腾片中含维生素C:9mg×$\frac{10mL}{50mL}$=1.8mg,
故答案为:移液管或酸式滴定管;25;1.8;
(4)应根据维生素C(C6H8O6)具有强还原性,可能极易被空气中的氧气氧化,还可能与碘水发生氧化还原反应,所以问题2维生素C被空气中的氧气氧化,问题1,请设计实验方案向葡萄糖与少量碘水的混合体系中加入淀粉,观察溶液是否变蓝,
故答案为:维生素C被空气中的氧气氧化;向葡萄糖与少量碘水的混合体系中加入淀粉,观察溶液是否变蓝.
点评 本题为实验习题,考查物质性质的实验探究方法和实验设计和分析判断,滴定实验分析、计算应用,实验数据的分析判断和目的分析,综合性较强,有一定的难度.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 解释或实验结论 |
| (1)取9.0g有机物A加热使其气化,测得其密度是相同条件下H2的45倍 | (1)由此可知A的相对分子质量为90. |
| (2)将9.0gA在足量O2中充分燃烧,其产物依次缓缓通过浓硫酸、碱石灰,两者分别增重5.4g和13.2g. | (2)由此可知A的分子式为C3H6O3. |
| (3)另取A9.0g,跟足量的NaHCO3粉末反应,生成CO2气体2.24L;9.0gA若与足量金属钠反应生成H2也是2.24L(气体体积皆为标准状况下测得). | (3)由此可知A中含有官能团有.(填结构简式)-COOH、-OH |
(4)A的核磁共振氢谱如下图: | (4)由此可知A中含有4种不同性质的氢原子 (5)综上,A的结构简式为  . . |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
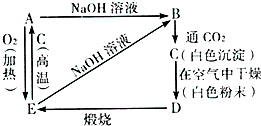 根据如图反应及其变化,回答有关问题.
根据如图反应及其变化,回答有关问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com