
| A. | 4 v(NH3)=5 v(O2) | B. | 5 v(O2)=6 v(H2O) | C. | 5 v(NO)=4 v(O2) | D. | 3 v(H2O)=2 v(NH3) |
分析 不同物质表示的速率之比等于化学计量数之比,据此计算判断.
解答 解:不同物质表示的速率之比等于其化学计量数之比,对于反应4NH3+5O2?4NO+6H2O,
A.v(NH3):v(O2)=4:5,则5 v(NH3)=4 v(O2),故A错误;
B.v(O2):v(H2O)=5:6,则6 v(O2)=5 v(H2O),故B错误;
C.v(NO):v(O2)=4:5,则5 v(NO)=4 v(O2),故C正确;
D.v(H2O):v(NH3)=6:4=3:2,则2 v(H2O)=3 v(NH3),故D错误.
故选:C.
点评 本题考查化学反应速率的有关计算,比较基础,注意速率计算常用方法有定义法与化学计量数法,同一反应不同的物质来表示化学反应速率,数值不同但意义相同,且化学反应速率之比等于化学计量数之比.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和滴定中,既可用标准溶液滴定待测溶液,也可用待测溶液滴定标准溶液 | |
| B. | 进行中和滴定操作中,眼睛要始终注视滴定管内溶液液面的变化 | |
| C. | 测定中和热时,两烧杯间填满碎纸的作用是固定小烧杯 | |
| D. | 若用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.50mo1•L-1的硫酸充分反应,两反应的中和热不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.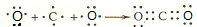
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
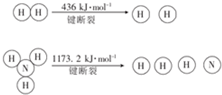
 .
.
| n(N2)/mol | N(H2)/mol | N(NH3)/mol | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
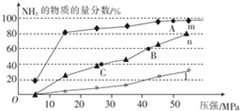
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com