

 ,碘单质从碘水中提取可以采用萃取分液法,利用四氯化碳来萃取,然后根据四氯化碳和碘的沸点的不同来分离,
,碘单质从碘水中提取可以采用萃取分液法,利用四氯化碳来萃取,然后根据四氯化碳和碘的沸点的不同来分离, ;萃取、蒸馏.
;萃取、蒸馏.

 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
| aNa |
| 58.5 |
| b |
| 58.5 |
| b |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
我省自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的。粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,请回答粗盐提纯的有关问题:
(1)为了除去粗盐中的泥沙,可采用的提纯方法的实验操作方法的名称是 。
(2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤加适量盐酸。其中,在步骤③中涉及的离子反应方程式有
(3)将ag粗盐样品溶于水,经过以上一系列提纯操作之后,实验完毕得到bg精盐(不考虑实验过程中操作引起的损耗),下列说法正确的是 。(NA表示阿伏伽德罗常数)
A.粗盐中Na+数目为 B.精盐中NaCl物质的量为 mol
C.粗盐中NaCl的质量分数为 x100℅ D.粗盐中关于NaCl的量无法确定
(4)含碘食盐往往加入KIO3,为了检验实验中是否含KIO3,可以用以下反应进行:
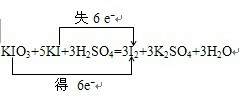
KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
①用单线桥分析以上反应中电子转移的方向和数目。
②将以上反应改写成离子方程式 。
③为了获取反应后溶液中的I2,可采用的实验操作方法的名称是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
我省自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的。粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,请回答粗盐提纯的有关问题:
(1)为了除去粗盐中的泥沙,可采用的提纯方法的实验操作方法的名称是 。
(2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤加适量盐酸。其中,在步骤③中涉及的离子反应方程式有
(3)将ag粗盐样品溶于水,经过以上一系列提纯操作之后,实验完毕得到bg精盐(不考虑实验过程中操作引起的损耗),下列说法正确的是 。(NA表示阿伏伽德罗常数)
A.粗盐中Na+数目为 B.精盐中NaCl物质的量为 mol
C.粗盐中NaCl的质量分数为 x100℅ D.粗盐中关于NaCl的量无法确定
(4)含碘食盐往往加入KIO3,为了检验实验中是否含KIO3,可以用以下反应进行:
KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
①用单线桥分析以上反应中电子转移的方向和数目。
②将以上反应改写成离子方程式 。
③为了获取反应后溶液中的I2,可采用的实验操作方法的名称是 。
查看答案和解析>>
科目:高中化学 来源:2010年四川省高一上学期期中考试化学试卷 题型:填空题
我省自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的。粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,请回答粗盐提纯的有关问题:
(1)为了除去粗盐中的泥沙,可采用的提纯方法的实验操作方法的名称是 。
(2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤加适量盐酸。其中,在步骤③中涉及的离子反应方程式有
(3)将ag粗盐样品溶于水,经过以上一系列提纯操作之后,实验完毕得到bg精盐(不考虑实验过程中操作引起的损耗),下列说法正确的是 。(NA表示阿伏伽德罗常数)
A.粗盐中Na+数目为 B.精盐中NaCl物质的量为 mol
C.粗盐中NaCl的质量分数为 x100℅ D.粗盐中关于NaCl的量无法确定
(4)含碘食盐往往加入KIO3,为了检验实验中是否含KIO3,可以用以下反应进行:
KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
①用单线桥分析以上反应中电子转移的方向和数目。
②将以上反应改写成离子方程式 。
③为了获取反应后溶液中的I2,可采用的实验操作方法的名称是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com