

分析 (1)NO可以被含Ce4+的溶液吸收,生成NO2-、NO3-,反应过程中N化合价升高,Ce化合价则降低,氧化剂为Ce4+,还原剂为NO;
(2)①采用电解法将NO2-转化为无毒物质,同时再生Ce4+,过程中Ce化合价升高,为失电子反应,电解池中阳极处的反应为失电子反应;
②电解池阴极发生的反应为物质得到电子,发生还原反应,根据装置图,H+到阴极参加反应,电解将NO2-转化为无毒物质,可判断为N2,据此写出电极反应;
(3)①焙烧过程中,CeFCO3转化生成CeO2和CeF4,焙烧过程O2参加反应,据此写出主要反应的方程式;
②有同学认为酸浸过程中用稀硫酸和H2O2替换盐酸更好,主要是考虑到HCl可能反应会产生Cl2,Cl2有的污染环境,采用H2O2是绿色氧化剂,不污染环境;
③根据溶度积常数和多重平衡规则计算反应的化学平衡常数;
④加热CeCl3•6H2O和NH4Cl的固体混合物可得固体无水CeCl3,考虑到Ce是镧系重金属,重金属离子会水解,NH4Cl的作用是调控溶液为酸性,抑制CeCl3的水解.
解答 解:(1)NO可以被含Ce4+的溶液吸收,生成NO2-、NO3-,反应过程中N化合价升高,Ce化合价则降低,氧化剂为Ce4+,还原剂为NO,生成NO2-、NO3-(二者物质的量之比为1:1),根据电子得失守恒,n(Ce4+)=n(NO2-)+3n(NO3-),根据元素守恒,n(NO)=n(NO3-)+n(NO2-),且n(NO2-)=n(NO3-),则氧化剂与还原剂的物质的量之比为n(Ce4+):n(NO)=4:2=2:1,
故答案为:2:1;
(2)①采用电解法将NO2-转化为无毒物质,同时再生Ce4+,过程中Ce化合价升高,为失电子反应,电解池中阳极处的反应为失电子反应,根据装置图,左侧为阳极室,所以Ce4+从电解槽的a处流出,
故答案为:a;
②电解池阴极发生的反应为物质得到电子,发生还原反应,根据装置图,H+到阴极参加反应,电解将NO2-转化为无毒物质,可判断为N2,则阴极的电极反应式:2NO2-+8H++6e-=N2↑+4H2O,
故答案为:2NO2-+8H++6e-=N2↑+4H2O;
(3)①焙烧过程中,CeFCO3转化生成CeO2和CeF4,焙烧过程O2参加反应,为氧化还原反应,则焙烧过程中发生的主要反应方程式为:4CeFCO3+O2$\frac{\underline{\;高温\;}}{\;}$3CeO2+CeF4+4CO2,
故答案为:4CeFCO3+O2$\frac{\underline{\;高温\;}}{\;}$3CeO2+CeF4+4CO2;
②有同学认为酸浸过程中用稀硫酸和H2O2替换盐酸更好,主要是考虑到HCl可能反应会产生Cl2,Cl2有的污染环境,采用H2O2是绿色氧化剂,不污染环境,
故答案为:不释放氯气,减少对环境的污染;
③反应为:Ce(BF4)3(s)+3KCl(aq)?3KBF4(s)+CeCl3(aq),
离子方程式为:Ce(BF4)3(s)+3K+(aq)?3KBF4(s)+Ce3+(aq),
则反应的化学平衡常数为K=$\frac{c(C{e}^{3+})}{{c}^{3}(C{l}^{-})}$,
Ce(BF4)3、KBF4的Ksp分别为a、b,所以Ksp[Ce(BF4)3]=c(Ce3+)c3(BF4-)=a,Ksp(KBF4)=c(K+)c(BF4-)=b,
根据多重平衡规则,则反应的化学平衡常数为K=$\frac{c(C{e}^{3+})}{{c}^{3}(C{l}^{-})}$=$\frac{c(C{e}^{3+})}{{c}^{3}({K}^{+})}•\frac{{c}^{3}(B{F}_{4}^{-})}{{c}^{3}(B{F}_{4}^{-})}$=$\frac{{K}_{sp}[Ce(B{F}_{4})_{3}]}{{K}_{sp}^{3}(KB{F}_{4})}$=$\frac{a}{{b}^{3}}$,
故答案为:$\frac{a}{{b}^{3}}$;
④加热CeCl3•6H2O和NH4Cl的固体混合物可得固体无水CeCl3,考虑到Ce是镧系重金属,重金属离子会水解,NH4Cl的作用是调控溶液为酸性,抑制CeCl3的水解,
故答案为:NH4Cl固体分解产生的HCl可以抑制CeCl3的水解.
点评 本题考查了电解原理和氧化还原反应的相关知识,注意氧化还原方程式的书写和配平,电极反应式的书写,也涉及到根据多重平衡规则计算化学平衡常数,盐类水解的知识,属综合题型,试题有助于培养综合运用化学知识的能力,为高频考点,题目难度中等.值得一提的是,重金属元素一般价层含有较多的空轨道,易水解.


科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的甲烷与氯气反应后体积保持不变 | |
| B. | 石蜡油、苯、环己烷都不能使溴的四氯化碳溶液褪色 | |
| C. | 分子式为C5H12的有机物有三种,它们互为同系物 | |
| D. | C4H8Cl2有8种同分异构体(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定时间 (h) | 0 | 1 | 2 | 4 | 8 |
| 雨水的pH值 | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; ;
; 所含官能团的名称是碳碳双键,醛基;该有机物发生加聚反应后,所得产物的结构简式为
所含官能团的名称是碳碳双键,醛基;该有机物发生加聚反应后,所得产物的结构简式为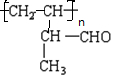 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  中共面的碳原子最多有13个 中共面的碳原子最多有13个 | |
| B. |  的一氯代物有3种 的一氯代物有3种 | |
| C. | 乙二酸二乙酯与乙二酸乙二酯互为同分异构体 | |
| D. |  由2种单体经过加聚反应合成 由2种单体经过加聚反应合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:8 | B. | 8:1 | C. | 1:5 | D. | 5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减少对环境的污染 | |
| B. | 研究变换基本原料和起始化合物 | |
| C. | 设计对人类健康和环境更安全的化合物 | |
| D. | 防患于未然,最终杜绝化学污染源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com