
【题目】已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍。现以A为主要原料合成F和高分子化合物E,其合成路线如图所示。

(1)A的结构式为__________,B中决定其性质的重要官能团的名称为____________。
(2)写出反应的化学方程式并判断反应类型。
①____________________________________反应类型:__________。
②_____________________________________反应类型:__________。
(3)实验室怎样鉴别B和D?_________________________。
(4)在实验室里我们可以用如下图所示的装置来制取F,乙中所盛的试剂为_______,该溶液的主要作用是_____________________________________;
(5)该装置图中有一个明显的错误是_____________________________。

【答案】 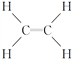 羟基 2CH3CH2OH+O2
羟基 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应 CH3COOH+CH3CH2OH
2CH3CHO+2H2O 氧化反应 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 酯化反应(或取代反应) 取某一待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,余下一种为乙醇(或其他合理方法) 饱和碳酸钠溶液 与挥发出来的乙酸反应,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层析出 导气管的出口伸入到了液面以下
CH3COOCH2CH3+H2O 酯化反应(或取代反应) 取某一待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,余下一种为乙醇(或其他合理方法) 饱和碳酸钠溶液 与挥发出来的乙酸反应,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层析出 导气管的出口伸入到了液面以下
【解析】A的产量通常用来衡量一个国家的石油化工水平,应为乙烯,结构简式为CH2=CH2,乙烯和水在催化剂条件下发生加成反应生成乙醇,乙醇被催化氧化生成乙醛,乙醇和乙酸在浓硫酸作用下反应生成乙酸乙酯,高分子化合物E应为聚乙烯,则
(1)的产量通常用来衡量一个国家的石油化工水平,应为乙烯,结构简式为CH2=CH2,乙烯和水在催化剂条件下发生加成反应生成乙醇,即B为乙醇,含有羟基,故答案为:CH2=CH2;羟基;(2)①B为乙醇,乙醇被催化氧化生成乙醛,反应的化学方程式为: 2CH3CH2OH+O2![]() 2CH3CHO+2H2O;反应类型为氧化反应 ②乙醇和乙酸在浓硫酸作用下发生酯化反应生成乙酸乙酯,反应的方程式为:CH3COOH+CH3CH2OH
2CH3CHO+2H2O;反应类型为氧化反应 ②乙醇和乙酸在浓硫酸作用下发生酯化反应生成乙酸乙酯,反应的方程式为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O ;反应类型为酯化反应(或取代反应);(3)实验室鉴别B乙醇和D乙酸:取某一待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,余下一种为乙醇(或其他合理方法);(4)实验室制取乙酸乙酯,乙中所盛的试剂为饱和碳酸钠溶液 ;该溶液的主要作用是:与挥发出来的乙酸反应,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层析出 ;(5)该装置图中有一个明显的错误是:导气管的出口伸入到了液面以下,会引起倒吸。
CH3COOCH2CH3+H2O ;反应类型为酯化反应(或取代反应);(3)实验室鉴别B乙醇和D乙酸:取某一待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,余下一种为乙醇(或其他合理方法);(4)实验室制取乙酸乙酯,乙中所盛的试剂为饱和碳酸钠溶液 ;该溶液的主要作用是:与挥发出来的乙酸反应,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层析出 ;(5)该装置图中有一个明显的错误是:导气管的出口伸入到了液面以下,会引起倒吸。


科目:高中化学 来源: 题型:
【题目】下列反应中,熵显著减少的反应是 ( )
A. CO(g)+2H2(g)= CH3OH(g)
B. CaCO3(s)+2HCl(aq)= CaCl2(aq)+CO2(g)+H2O(l)
C. (NH4)2CO3(s)= NH4HCO3(s)+NH3(g)
D. 2HgO(s)= 2Hg(l)+O2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. P4和CH4都是正四面体分子且键角都为109o28ˊ
B. H2O是一种非常稳定的化合物,这是由于氢键所致
C. NO3-和CO32-是等电子体,均为平面正三角形结构
D. 金属晶体与熔融态的离子晶体导电都是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。下列说法正确的是( )
X | Y | |
Z | W |
A.元素W位于第三周期第ⅤA族
B.元素Y的氢化物水溶液呈酸性
C.元素X、Z的各种氯化物分子中,各原子均满足8电子稳定结构
D.元素X与氢元素形成的原子个数比为1∶1的化合物有多种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 天然油脂的分子中含有酯基,属于酯类
B. 苯的分子式为C6H6,分子中的碳原子远远没有饱和,因此能和氯水发生加成反应
C. 所有卤代烃都难溶于水,且都是密度比水大的液体
D. 天然气与液化石油气的成分相同,与水煤气的成分不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I).常温下0.01mol/L HCl溶液由水电离产生的c(H+)与PH=11的CH3COONa溶液中由水电离产生的c(OH-)之比为________。
(II).实验室中配制AgNO3溶液时通常需要向其中加入硝酸目的是______;AgCl在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq)。25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2molL-1AgNO3溶液;③100mL 0.1molL-1氯化镁溶液;④100mL 0.1molL-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是______ (填写序号)。
Ag+(aq)+Cl-(aq)。25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2molL-1AgNO3溶液;③100mL 0.1molL-1氯化镁溶液;④100mL 0.1molL-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是______ (填写序号)。
(III).己知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+ △H>0。
CH3COO-+H+ △H>0。
(1) 25 C时,浓度均为0.lmol/L的盐酸和醋酸溶液,下列说法正确的是__________;
①两溶液的pH相同
②两溶液的导电能力相同
③由水电离出的c(OH-)相同
④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
(2)25℃时,在pH=5的稀醋酸溶液中,c(CH3COO-)=_________(填数字表达式);
(3)25℃时,若向氨水中加入稀盐酸至溶液的pH==7,此时c(NH4 +) =amol/L,则c(Cl-)=__________。
(4)25℃时,向体积为VamL pH=3的醋酸溶液中滴加pH=11的NaOH溶液VbmL至溶液恰好呈中性,则Va与的Vb关系是Va____vb (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不导热的恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
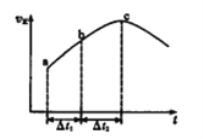
A. 反应物浓度:a点小于c点
B. c点时反应进行的程度最大
C. 该反应的正反应为吸热反应
D. △t1=△t2时,生成H2的物质的量:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4===ZnSO4+H2↑
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置______(填代号)和制备并收集干燥、纯净Cl2的装置______(填代号)。
可选用制备气体的装置:


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铁及其化合物的说法正确的是
A.赤铁矿的主要成分是Fe3O4
B.除去FeCl2 溶液中的FeCl3杂质可以向溶液中加锌粉,然后过滤
C.磁铁矿粉末溶于盐酸后,加入KSCN溶液,溶液变红色
D.Fe3O4俗称铁红
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com