
 OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$
OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$ Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择( )
Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择( )| A. |  | B. |  | C. |  | D. |  |
分析 根据反应原理: OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$
OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$ Br+NaHSO4+H2O,制取溴代环戊烷反应条件为需水浴控制温度,需温度计,据此选择装置.
Br+NaHSO4+H2O,制取溴代环戊烷反应条件为需水浴控制温度,需温度计,据此选择装置.
解答 解:用环戊醇(沸点160.8℃,密度0.96g/mL)与溴化氢反应制备溴代环戊烷(沸点138℃,密度1.37g/mL),其反应原理如下: OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$
OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$ Br+NaHSO4+H2O,则制备溴代环戊烷,需水浴加热,且需用温度计控制反应的温度为75-80℃,装置A、D未进行水浴,且A无温度计,故A、D不选;B装置缺少温度计,故B不选,只有装置C条件都符合,
Br+NaHSO4+H2O,则制备溴代环戊烷,需水浴加热,且需用温度计控制反应的温度为75-80℃,装置A、D未进行水浴,且A无温度计,故A、D不选;B装置缺少温度计,故B不选,只有装置C条件都符合,
故选C.
点评 本题考查了制取装置的选择,题目难度不大,注意从其反应原理得出反应条件进行装置选择是解答关键,试题培养了学生灵活应用信息的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 丙 | ||
| 甲 | 乙 |
| A. | 单质熔沸点从高到低:甲>乙>丙 | B. | 气态氢化物的热稳定性:丙>甲>乙 | ||
| C. | 元素最高价态:丙>乙>甲 | D. | 原子半径从大到小:甲>乙>丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

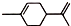 ),则A的系统命名是2-甲基-1,3-丁二烯.在合成M的过程中还可以生成M的一种同分异构体,其结构简式为
),则A的系统命名是2-甲基-1,3-丁二烯.在合成M的过程中还可以生成M的一种同分异构体,其结构简式为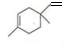 .
.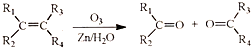 (R1、R2、R3、R4为烃基或氢原子)
(R1、R2、R3、R4为烃基或氢原子)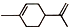 )发生上述反应的产物中分子量较大的结构简式
)发生上述反应的产物中分子量较大的结构简式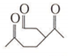 .
.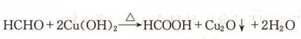 .
.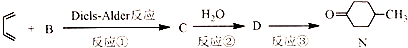
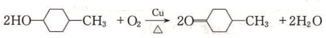 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的单质在自然界只有一种核素 | |
| B. | 元素C、D、E的简单离子的半径依次减小 | |
| C. | E的单质氧化性最强 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 近年来禽流感病毒H7N9时有病例报告,卫生部门强调要尽量避免接触活禽,个人也应加强消毒预防,其中消毒剂可以选用含氯消毒剂、酒精、双氧水等适宜的物质 | |
| B. | 将浸泡过高锰酸钾溶液的硅藻土放入新鲜的水果箱内是为了催熟水果 | |
| C. | “埃博拉”病毒在常温下较稳定,对热有中等度抵抗力,56℃不能完全灭活,60℃30min方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| D. | 用二氧化碳制全降解塑料,可以缓解温室效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com