
【题目】2017年我国科学家研发了一种可充电镁一溴电池,其工作原理如图所示,电池的中间是只允许镁离子通过的离子选择性膜。电池的总反应为Mg+NaBr3===NaBr+MgBr2。下列说法错误的是( )

A. 放电过程中Mg2+通过离子选择性膜从负极区移向正极区
B. 放电时,正极反应式为Br3-+2e-=3Br-
C. 负极区电解液若改为镁盐的水溶液,则会发生副反应:Mg+2H2O===Mg(OH)2+H2↑
D. 充电过程中当0.1molMg2+通过离子选择性膜时,外电路导线中通过0.1mol电子
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质。设计了如下图所示装置进行实验.
已知:1.0 mol/L的Fe(NO3)3溶液的pH=1。

请回答:
(1)装置A中用于添加浓硫酸的仪器名称为__________________。
(2)实验前鼓入N2的目的是________________________________。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是_________________。
②按观点2,装置B中反应的离子方程式是______________________________,
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号)_____。
A.1 mol/L稀硝酸 |
B.1.5 mol/L Fe(NO3)2溶液 |
C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g) ΔH<0,升高温度可使平衡向逆反应方向移动
CO2(g)+NO(g) ΔH<0,升高温度可使平衡向逆反应方向移动
B. 合成NH3的反应,为提高NH3的产率,理论上应采取相对较低的温度
C. 溴水中存在平衡:Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
D. 对2HI(g)![]() H2(g)+I2(g),增大平衡体系的压强(压缩体积)可使体系颜色变深
H2(g)+I2(g),增大平衡体系的压强(压缩体积)可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知①Na2O2 ②O2 ③HClO ④H2O2 ⑤Cl2 ⑥NaClO ⑦O3七种物质都具有强氧化性。请回答下列问题:
(1)上述物质中互为同素异形体的是_____(填序号,下同)。
(2)含非极性键的共价化合物是_________。
(3)属于离子化合物的有______种。
(4)Na2O2、HClO、H2O2均能用于制备O2。
①HClO在光照条件下分解生成O2和HCl,用电子式表示HCl的形成过程:_________________________。
②写出Na2O2与H2O反应制备O2的化学方程式:____________________________________。
③H2O2在二氧化锰催化作用下可以制备O2。若6.8g H2O2参加反应,则转移电子数目为_________,生成标准状况下O2体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4支试管中分别进行如下表所示实验,结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH |
B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
C | 滴加氯水和CCl4,振荡,静置 | 下层溶液显紫色 | 原溶液中有I- |
D | 通入过量CO2气体 | 生成白色沉淀 | 原溶液中只有AlO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备备受人们的关注。
(1)一定温度下,在2L恒容密闭的容器中充入2.0molN2O5发生反应:2N2O5(g)![]() 4NO2(g)+O2(g)。在三种不同的条件下进行实验,N2O5的浓度随时间的变化如图所示。
4NO2(g)+O2(g)。在三种不同的条件下进行实验,N2O5的浓度随时间的变化如图所示。

①已知:2N2O5(g)===2N2O4(g)+O2(g) △H1=-4.4kJ/mol
2NO2(g)===N2O4(g) △H2=-55.3 kJ/mol
则反应2N2O5(g)===4NO2(g)+O2(g)的△H=________。
②下列不能说明该反应已达平衡状态的是___(填序号)。
A.v正(N2O5)=2v逆(O2)
B.混合气体密度不变
C.混合体平均摩尔质量
D.NO2的体积分数不变
③该反应自发进行的条件是____(填“高温”或“低温”),实验Ⅲ中:a点v逆(O2)____(填“<”或“>”)b点v逆(O2)。
④实验Ⅱ从反应开始至平衡时,v(O2)=____mol/(L·min)。
⑤列式并计算该反应在800℃时的平衡常数K=_______。
(2)1840年Devil用干燥的氯气通过干燥的硝酸银,反应得到N2O5。该反应的氧化产物是一种气体,该反应的化学方程式为_______。
(3)N2O5也可采用“电解法”制备,装置如图所示。

则N2O5在电解池的____(填“阴极”或“阳极”)室生成,其电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用一种铝铁合金为原料,模拟相关的工业生产,反应过程如图所示(部分产物和条件已略去),请回答:

(1)铁铝合金是一种高电磁性能合金,下列有关推测可能正确的是_____(填序号).
A.铁铝合金可由铁和铝熔融混合制成
B.铁铝合金的熔点高于铝和铁
C.铁铝合金硬度高于纯铝
(2)反应①中铝元素发生反应的离子方程式为_______________________。
(3)反应②的化学方程式为____________________________________。
(4)反应③发生时观察到的现象是_____________________________,用化学方程式表示颜色变化的原因_____________________________________。
(5)反应④中的CO2不宜换成HCl,原因是_____________________。
(6)请举出固体A一种用途_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.是一种重要的有机合成中间体,由芳香烃A和E为有机原料和其他必要试剂制备Ⅰ的合成路线如图:
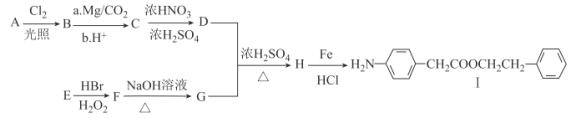
已知:Ⅰ.RX![]() RCOOH;
RCOOH;
Ⅱ.R—CH=CH2![]() R—CH2CH2Br;
R—CH2CH2Br;
Ⅲ.![]() 。
。
请回答下列问题:
(1)A的分子式为___。Ⅰ中含有官能团的名称为_____。
(2)C→D、H→I的反应类型分别为____、____。
(3)E的化学名称为______,一定条件下,E发生加聚反应的化学方程式为____。
(4)F→G的化学方程式为____。
(5)H的结构简式为____。
(6)同时满足下列条件的C的同分异构体有__种(不考虑立体异构);其中核磁共振氢谱有5组峰的结构简式为____。
①能与FeCl3溶液发生显色反应
②能发生银镜反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com