
分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合物质的构成计算.
解答 解:(1)n(B5H9)=$\frac{96g}{64g/mol}$=1.5mol,N(B)=1.5mol×6.02×1023/mol×5=4.515×1024,故答案为:4.515×1024;
(2)N=$\frac{4.214×1{0}^{24}}{6.02×1{0}^{23}/mol}$=7mol,则n(B5H9)=$\frac{7mol}{14}$=0.5mol,m(B5H9)=0.5mol×64g/mol=32g,故答案为:32.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用以及构成特点,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
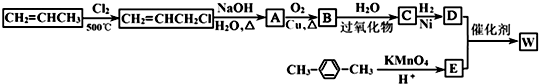
 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$
 .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸和硝酸银溶液 | B. | 氢气在氯气中燃烧 | ||
| C. | 钠与氧气的反应 | D. | 一氧化碳在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态HBr不导电,因此HBr是非电解质 | |
| B. | 自由移动离子数目多的电解质溶液导电能力不一定强 | |
| C. | CO2的水溶液能导电,因此CO2是电解质 | |
| D. | NaHSO4在水溶液及熔融状态下均可电离成Na+、H+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL0.5mol•L-1MgCl2溶液 | B. | 200mL0.25mol•L-1AlCl3溶液 | ||
| C. | 50mL1mol•L-1NaCl溶液 | D. | 25mL0.5mol•L-1HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AB3 | B. | AB | C. | A3B | D. | A3B2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com