
二氧化碳和氨是重要的化工产品,是纯碱工业、制造硝酸、铵盐和氮肥等的原料。
(1)CO2的电子式是 。
(2)以NH3与CO2为原料合成尿素[化学式为CO(NH2)2]的主要反应如下:
① 2NH3(g)+CO2(g) = NH2CO2NH4(s) △H=-l59.5 kJ·mol-1
② NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③ H2O(1) = H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式 ;
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
不同温度下NO产率如下图1所示,由此图可知温度对NO产率的影响规律为 ,请用化学反应速率和化学平衡理论解释其原因: 。
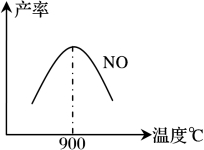
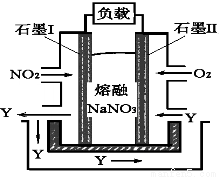
图1 图2
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关石墨I电极反应可表示为_______________。
(5)已知常温下NH3·H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。 常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显__________(填“酸性”、“中性”或“碱性”);计算反应NH4++HCO3—+H2O NH3·H2O+H2CO3的平衡常数K= (结果保留2位有效数字)。
NH3·H2O+H2CO3的平衡常数K= (结果保留2位有效数字)。
 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源:2016-2017学年江苏省高二学业水平测试化学试卷(解析版) 题型:选择题
下列物质转化常通过加成反应实现的是
A.  B. CH3CH2OH→CH3CHO
B. CH3CH2OH→CH3CHO
C. CH4→CH3Cl D. CH2=CH2→CH3CH2Br
查看答案和解析>>
科目:高中化学 来源:2017届河南省豫南九校高三下学期质量考评七理综化学试卷(解析版) 题型:选择题
下列操作不能达到目的的是
选项 | 目的 | 操作 |
A | 配制100mL1.0mol/LCuSO4溶液 | 将25.0gCuSO4·5H2O溶于100mL蒸馏水中 |
B | 除去NaCl固体中少量的Na2CO3 | 将混合物溶于水,再加入稍过量的盐酸,再加热蒸发结晶 |
C | 使Na2SO3溶液中的SO32-完全转化为SO42- | 向Na2SO3溶液中加入过量的H2O2溶液 |
D | 确定KI溶液中的碘离子是否被部分氧化 | 取少量溶液于试管中,向其中滴加少量淀粉溶液,观察溶液是否变蓝色,再另取少量溶液滴加AgNO3溶液,观察溶液是否产生黄色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三适应性月考(六)理综化学试卷(解析版) 题型:填空题
氨在国民经济中占有重要地位。
I.合成氨工业中,初始时氮气、氢气的体枳比为1:3时,每反应1mol N2,放出92.2kJ热量。
(1)工业合成氨的热化学方程式是_________________。
(2)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数。
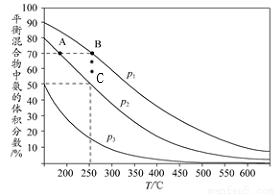
①由图可知:p1、p2、p3的大小关系为____________,理由是___________________。
②A、B点生成氨气的速率大小关系为____________________。B、C点,合成氨反应的化学平衡常数大小关系为__________,C点,N2的转化率为_____。③下列关于合成氨的说法正确是______(填序号)。
A.断开1个N=N键的同时有6个N—H键形成,反应一定达到平衡状态
B.混合气体的平均相对分子质量不再改变状态,反应一定达到平衡状态
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
D.增大n(N2):n(H2)的比值,有利用提离H2的转化率
II.最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其电池反应为4NH3+3O2==2N2+6H2O,你认为电解质溶液应显_______(填“酸性”“中性”或“碱性”),写出负极的电极反应式:_________。若电池产生的电流为1A,反应时间为1小时,氨气的转化率为80%,则最低需要______mol氨气(列出计算式即可,已知一个电子的电量是1.6×10-19C)。
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三适应性月考(六)理综化学试卷(解析版) 题型:选择题
生活中常见的荧光棒的发光原理可用图表示:

荧光染料分子获取上述反应产生的能量后释放出荧光。下列说法正确的是
A. 苯酚苯环上的二氯代物共有6种
B. 苯酚上的所有原子一定共平面
C. 荧光棒发光过程涉及光能到化学能的转化
D. 二苯基草酸酯与草酸( )互为同系物
)互为同系物
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三下学期周练(四)理科综合化学试卷(解析版) 题型:选择题
下列关于实验Ⅰ~Ⅳ的说法正确的是
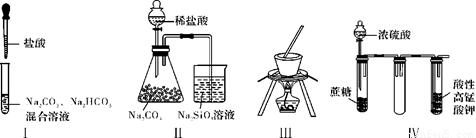
A. 实验Ⅰ:逐滴滴加盐酸时,试管中立即产生大量气泡
B. 实验Ⅱ:通过实验现象可比较氯、碳、硅三种元素的非金属性强弱
C. 实验Ⅲ:本装置可以用于从饱和食盐水制取NaCl晶体
D. 实验Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:推断题
U、V、W、X、Y、Z是原子序数依次增大的短周期元素。已知:
①WU4++XU-==WU3+U2X,各种反应物和生成物的电子总数都与Y+相等;
②Z的单质在X2中燃烧的产物可使品红溶液褪色;
③V的单质在X2中燃烧可生成VX和VX2两种气体;
④Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)写出Y2X2与水反应的化学方程式:________________。
(2)V、W、X形成的10电子氢化物中,沸点最高的是__________(写化学式)。
(3)U2X2与FeSO4按物质的量之比1:2溶于稀硫酸中,反应的离子方程式为__________。
(4)常温下,向pH=11的Y2VX3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是_________。
(5)已知由U、W两种元素组成的共价化合物联氨的球棍模型如图所示,则联氨分子的电子式为____________。联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为_______(已知:N2H4+H+==N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与过量硫酸形成的酸式盐的化学式为______________。
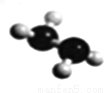
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
实验室里需要配制480mL 0.10mol·L-1的硫酸铜溶液,下列实验方案及实验操作正确的是
选项 | 容量瓶容积 | 溶质质量 | 实验操作 |
A | 480mL | 硫酸铜:7.68g | 加入 500mL水 |
B | 480mL | 胆矾:12.0g | 配成500mL溶液 |
C | 500mL | 硫酸铜:8.0g | 加入500mL水 |
D | 500mL | 胆矾:12.5g | 配成500mL溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二3月月考化学试卷(解析版) 题型:选择题
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3﹣Na2O,O2﹣可以在其中自由移动.
下列有关叙述正确的是( )
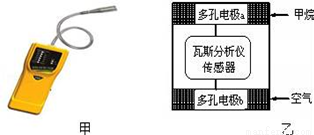
A. 电极a的反应式为:CH4+4O2﹣﹣8e﹣=CO2+2H2O
B. 电极b是正极,O2﹣由电极a流向电极b
C. 瓦斯分析仪工作时,电池内电路中电子由电极 a流向电极b
D. 当固体电解质中有2 mol O2﹣通过时,外电路通过电子8 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com