
��16�֣���1������д���пհ״���ʵ������Ҫ����500mL0.2mol/L����������Һ��ʵ�鲽������У�
| A������ƽ�ϳƳ�___________g�����ƹ��壬���������ձ��������������ˮ�ܽ⡣ |
| B���ѵõ�����ҺС�ĵ�����__________ע��________mL������ƿ�С� |
| C������������ˮϴ���ձ��Ͳ�����2��3�Σ�ÿ��ϴ��ҺҲС��ת������ƿ�С� |
| D������������ƿ�м�����ˮ��Һ���̶���������_______________С�ĵμ�����ˮ����Һ��Һ��ײ���̶���ˮƽ���С� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���Ӵ��� | A | B | C | D | E | F | G |
| ԭ�Ӻ˸��� | ���� | ���� | ˫�� | �ĺ� | ���� | ��� | ��� |
| ����� | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
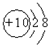
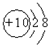


| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� | FeSO4 | H2SO4 | Ag2SO4 | Al2��SO4��2 | ���� |
| ��������/��%�� | 15.0 | 7.0 | 0.40 | 0.34 | 5.0 |
| �¶�/�� | 0 | 10 | 20 | 30 | 40 | 50 |
| FeSO4��Һ�ȣ�g�� | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 |
| Al2��SO4��3�ܽ�ȣ�g�� | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ������ɱ���ܱ������г���4mol A��1mol B���������·�Ӧ��4A(g)��B(s)??3C(s)��4D(g)���ڸ����´ﵽƽ�⣬��û��������D��Ũ��Ϊ0.3mol��L��1������д���пհף�
(1)���������Ϊ10L����Ӧ��2min��ƽ�⣬����A����Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ����Ϊ����������������������ƽ��ʱA���ʵ�ת����Ϊ��������������
(2)��ѹ����������ѹǿ�����淴Ӧ����������������������D�����������������(�������С�����䡱)��
(3)����Է�������M(B)>3M(C)���¶�����ʱ��������ƽ����Է���������С��������Ӧ��������(����ȡ����ȡ�)��
(4)������������иij�1.5mol C��4.4mol D���¶ȱ��ֲ��䣬Ҫʹ��Ӧ��ƽ��ʱD��Ũ��Ϊ0.6mol��L��1�����������������������L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��09-10�곤ɳͬ����ʵ��ѧУ�߶���ѧ����ĩ���Ի�ѧ�� ���ͣ������
��12�֣�t��ʱ����3mol
A��1mol B����ͨ�����Ϊ2L���ܱ������У��ݻ����䣩���������·�Ӧ��3A��g��+B��g�� xC��g������H<0����2minʱ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩ʣ����0.8molB�������C��Ũ��Ϊ0.4mol��L��1������д���пհף�
xC��g������H<0����2minʱ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩ʣ����0.8molB�������C��Ũ��Ϊ0.4mol��L��1������д���пհף�
��1���ӿ�ʼ��Ӧ���ﵽƽ��״̬������B��ƽ����Ӧ����Ϊ ��
��2��x= ��ƽ�ⳣ��K= ��
��3����������ԭƽ�������������ͨ���������������躤����A��B��C������Ӧ����ѧƽ�⣨����ĸ�� ��
A��������Ӧ�����ƶ� B�����淴Ӧ�����ƶ� C�����ƶ�
��4������ԭƽ��������������ٳ���a mol C����t��ʱ�ﵽ�µ�ƽ�⣬��ʱB�����ʵ���Ϊn��B��= mol��
��5�����������Ӧ����ͬ�¶Ⱥ������н��У���ʹ��Ӧ�ﵽƽ��ʱC�����ʵ���������ԭƽ����ȣ���ʼ������������ʵ����ʵ���n��A����n��B����n��C��֮��Ӧ������Ĺ�ϵʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com