
分析 (1)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19.3kJ/mol
依据盖斯定律①×3-(③×2+②)得到:6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)的△H,得到热化学方程式.
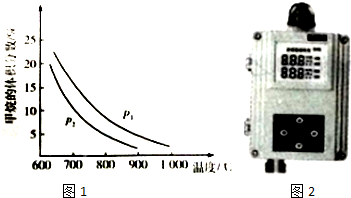
(2)①升高温度,化学平衡向着吸热方向进行,甲烷的体积分数减小;增加压强,甲烷的体积分数增大,据此回答;
②在恒温、恒压的条件下,向上述平衡体系中通人氮气,相当于体系减压,所以平衡正向移动;
(3)①根据平衡常数表达式结合三行式计算化学平衡常数;转化率等于变化量和初始量的比值;
(4)CO与O2反应生成CO2的燃料电池负极上是燃料燃烧的反应,据此回答.
解答 解:(1)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19.3kJ/mol
依据盖斯定律①×3-(③×2+②)得到:6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)△H=-66KJ/mol;得到热化学方程式为:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol,
故答案为:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol;
(2)①压强不变,升高温度,化学平衡向着吸热方向进行,甲烷的体积分数减小,所以正向进行,反应是吸热的;温度不变,增加压强,甲烷的体积分数增大,所以P1大;故答案为:吸热;<;
②在恒温、恒压的条件下,向上述平衡体系中通人氮气,相当于体系减压,所以平衡正向移动,故答案为:向正反应方向;
(3)CO+H2O(g)?CO2+H2,经过5min,反应达到平衡状态,此时测得平均反应速率v(CO2)=0.01mol/(L•min),得到二氧化碳的变化浓度是0.05,
初始浓度:0.1 0.1 0 0
变化浓度:0.05 0.05 0.05 0.05
平衡浓度:0.05 0.05 0.05 0.05
化学平衡常数K=$\frac{0.05×0.05}{0.05×0.05}$=1,达到平衡时CO的转化率为$\frac{0.05}{0.1}$×100%=50%;
故答案为:1;50%;
(4)CO与O2反应生成CO2的燃料电池负极上是燃料燃烧的反应,即CO+H2O-2e-=CO2+2H+,故答案为:CO+H2O-2e-=CO2+2H+.
点评 本题涉及热化学、化学平衡的计算以及化学平衡的移动、电化学等方面的知识,属于综合知识的考查题,难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
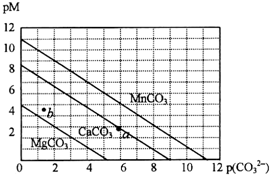 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列说法正确的是( )| A. | M离子浓度越大,pM值越大 | |
| B. | MgCO3、CaCO3、MnCO3的Ksp依次增大 | |
| C. | b点表示MgCO3为不饱和溶液,若表示CaCO3则有沉淀析出 | |
| D. | a点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
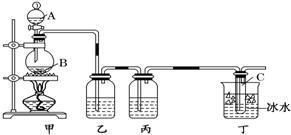
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
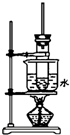 如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).
如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下11.2 L氢气所含的原子数目为NA | |
| B. | 18 g水所含的氢原子数目为NA | |
| C. | 2.3 g金属钠转化为Na2O和Na2O2的混合物时失去的电子数为0.1NA | |
| D. | 物质的量浓度为0.5 mol•L-1 的MgCl2溶液,含有的Cl- 数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上电解熔融Al2O3制备金属铝 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 金属锌与稀硫酸反应制取氢气,粗锌比纯锌反应速率快 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com