
【题目】工业上以铬铁矿(主要成分为FeOCr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O72H2O),其主要反应为:
(1)4FeOCr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4![]() Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A. 反应(1)和(2)均为氧化还原反应
B. 反应(1)的氧化剂是O2,还原剂是FeOCr2O3
C. 高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D. 反应(1)中每生成1molNa2CrO4时电子转移3mol
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 0.1mol SiO2晶体中含有Si-O键的数目为0.2NA
B. 56g铁粉与高温水蒸气反应,生成H2数目为1.5NA
C. 标准状况下,22.4 LCl2溶于水,转移电子数为NA
D. 18gH218O和2H2O的混合物中,所含中子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,装置正确且能达到实验目的的是

A. 用图a所示装置验证H2在Cl2中燃烧的实验现象
B. 用图b所示装置从饱和食盐水中提取氯化钠
C. 用图c所示装置探究氧化性:KMnO4>Cl2>I2
D. 用图d所示装置分解MgCl2·6H2O获取MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是

A. 过氧化钠 B. 氧化钠
C. 钠 D. 钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的是( )
A.Na+、Cu2+、Cl-、OH-B.H+、Ca2+、HCO3-、NO3-
C.Fe2+、H+、SO42-、NO3-D.Na+、CO32-、OH-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g) +B(g)![]() 2C(g)+2D(g)△H<0,反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g)△H<0,反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s内正反应的平均反应速率为: ;
(2)反应前A的物质的量浓度是: ;
(3)10s末,生成物D的浓度为 ;
(4)平衡后,若改变下列条件,生成D的速率如何变化(用“增大”、“减小”或 “不变”填空)。
编号 | 改变的条件 | 生成D的速率 |
① | 降低温度 | |
② | 增大A的浓度 | |
③ | 使用催化剂 | |
④ | 恒容下冲入Ne(不参与体系反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
镍及其化合物在工业生产和科研领域有重要的用途。请回答下列问题:
(1)基态 Ni 原子中,电子填充的能量最高的能级符号为______,价层电子排布式为________。
(2)Ni(CO)4 常用作制备高纯镍粉,其熔点为-19.3 ℃, 沸点为 43 ℃。则:
①Ni(CO)4 的熔、沸点较低的原因为________。
②写出一种与CO 互为等电子体的分子的化学式________。
③Ni(CO)4中 σ 键和 π 键的数目之比为________。
(3)NiSO4 常用于电镀工业,其中 SO42-的中心原子的杂化轨道类型为________,该离子中杂化轨道的作用是________。
(4)氧化镍和氯化钠的晶体结构相同,可看成镍离子替换钠离子,氧离子替换氯离子。 则:
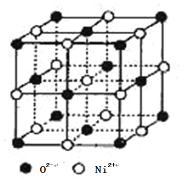
①镍离子的配位数为________。
②天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为Ni0.97O(相对分子质量为73), 其中 Ni 元素只有+2 和+3 两种价态, 两种价态的镍离子数目之比为________;若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,则该晶胞中最近的 O2-之间的距离为________pm(列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明的强酸性溶液中,能大量共存的一组离子是
A. Mg2+、A13+、SO42-、NO3- B. Na+、HCO3-、K+、SO42-
C. MnO4-、K+、SO42-、Na+ D. NH4+、Fe2+、Cl-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com