
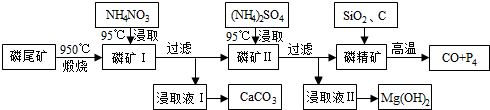
分析 磷尾矿[主要含Ca5(PO4)3F和CaCO3•MgCO3]在950℃下煅烧,其中碳酸钙和碳酸镁分解,生成气体的成分为二氧化碳(CO2),磷矿Ⅰ的主要成分为Ca5(PO4)3F、CaO、MgO,NH4NO3溶液中铵离子水解呈酸性,可溶解CaO,得到的浸取液Ⅰ含有Ca2+,可生成CaCO3,磷矿Ⅱ含有Ca5(PO4)3F、MgO,加入硫酸铵浸取,浸取液Ⅱ含有镁离子,可生成氢氧化镁,磷精矿加入二氧化硅、C等,在高温下发生4Ca5(PO4)3F+18SiO2+30C$\frac{\underline{\;高温\;}}{\;}$2CaF2+30CO+18CaSiO3+3P4,可生成P4,以此解答该题.
解答 解:磷尾矿[主要含Ca5(PO4)3F和CaCO3•MgCO3]在950℃下煅烧,其中碳酸钙和碳酸镁分解,生成气体的成分为二氧化碳(CO2),磷矿Ⅰ的主要成分为Ca5(PO4)3F、CaO、MgO,NH4NO3溶液中铵离子水解呈酸性,可溶解CaO,得到的浸取液Ⅰ含有Ca2+,可生成CaCO3,磷矿Ⅱ含有Ca5(PO4)3F、MgO,加入硫酸铵浸取,浸取液Ⅱ含有镁离子,可生成氢氧化镁,磷精矿加入二氧化硅、C等,在高温下发生4Ca5(PO4)3F+18SiO2+30C$\frac{\underline{\;高温\;}}{\;}$2CaF2+30CO+18CaSiO3+3P4,
(1)根据题给化学工艺流程和信息①知磷尾矿[主要含Ca5(PO4)3F和CaCO3•MgCO3]在950℃下煅烧,其中碳酸钙和碳酸镁分解,生成气体的成分为二氧化碳(CO2),故答案为:二氧化碳(CO2);
(2)实验室过滤所需的玻璃仪器是烧杯、漏斗和玻璃棒,故答案为:烧杯、漏斗和玻璃棒;
(3)NH4NO3溶液中铵离子水解呈酸性,H+能从磷矿I中浸取出Ca2+,故答案为:NH4+水解使溶液呈酸性,与CaO、Ca(OH)2反应生成Ca2+;
(4)根据化学工艺流程判断浸取液II的主要成分为硫酸镁溶液,通入NH3,发生反应的化学方程式是MgSO4+2NH3+2H2O=Mg(OH)2↓+(NH4)2SO4,
故答案为:MgSO4+2NH3+2H2O=Mg(OH)2↓+(NH4)2SO4;
(5)已知25℃,101kPa时:
①CaO(s)+H2SO4(l)═CaSO4(s)+H2O(l)△H=-271kJ/mol
②5CaO(s)+3H3PO4(l)+HF(g)═Ca5(PO4)3F(s)+5H2O(l)△H=-937kJ/mol
根据盖斯定律:①×5-②得Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是Ca5(PO4)3F (s)+5H2SO4(l)=5CaSO4(s)+3H3PO4(l)+HF(g)△H=-418kJ/mol,
故答案为:Ca5(PO4)3F (s)+5H2SO4(l)=5CaSO4(s)+3H3PO4(l)+HF(g)△H=-418kJ/mol;
(6)根据题给数据利用三行式分析.设CO的起始浓度为1mol/L,则水蒸气的起始浓度为5mol/L
CO(g)+H2O(g)?CO2(g)+H2(g),
起始浓度(mol/L)1 5 0 0
转化浓度(mol/L)$\frac{5}{6}$ $\frac{5}{6}$ $\frac{5}{6}$ $\frac{5}{6}$
平衡浓度(mol/L)$\frac{1}{6}$ $\frac{25}{6}$ $\frac{5}{6}$ $\frac{5}{6}$
则K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)C({H}_{2}O)}$=$\frac{\frac{5}{6}×\frac{5}{6}}{\frac{1}{6}×\frac{25}{6}}$=1.
相同条件下当CO与H2O(g)的起始物质的量之比为1:3,平衡常数不变,设转化的CO为x.
CO(g)+H2O(g)?CO2(g)+H2(g),
起始浓度(mol/L)1 3 0 0
转化浓度(mol/L)x x x x
平衡浓度(mol/L)(1-x) (3-x) x x
则$\frac{{x}^{2}}{(1-x)(3-x)}$=1,解得x=$\frac{3}{4}$,即达平衡时,CO转化了$\frac{3}{4}$,转化为P4的Ca5(PO4)3F质量为a×10%×b%kg,
根据反应4Ca5(PO4)3F+18SiO2+30C$\frac{\underline{\;高温\;}}{\;}$2CaF2+30CO+18CaSiO3+3P4知生成CO的质量为$\frac{30×28×a×10%×b%}{4×504}$kg,
则转化的CO的质量为$\frac{3}{4}$×$\frac{30×28×a×10%×b%}{4×504}$kg,
根据反应:CO(g)+H2O(g)?CO2(g)+H2(g)知相同条件下达平衡时能产生H2$\frac{3×(30×28×a×10%×b%)}{56×(4×504)}$=$\frac{ab}{44800}$kg.
故答案为:$\frac{ab}{44800}$.
点评 本题考查物质的制备,涉及化学反应原理,涉及化学反应速率、化学平衡、化学反应与能量等知识,题目难度较大,注意掌握实验的原理和流程,把握平衡常数的意义,试题计算量较大,充分培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:多选题
| A. | AB3是非极性分子 | B. | A原子无孤对电子 | ||
| C. | A原子为sp3杂化 | D. | AB3为三角锥形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
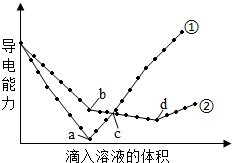 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | ①代表滴加H2SO4溶液的变化曲线 | |
| B. | b点,溶液中大量存在的离子是Na+、OH- | |
| C. | c点,两溶液中含有相同量的OH- | |
| D. | a、d两点对应的溶液均显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
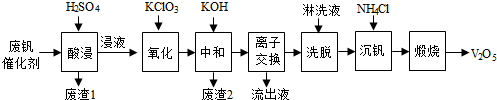
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子间的碰撞一定是有效碰撞 | |
| B. | 对于任何化学反应,增大压强均可使单位体积内活化分子数增多,反应速率加快 | |
| C. | 加入反应物,可增加活化分子百分数,从而增大化学反应速率 | |
| D. | 某反应的△H=100kJ•mol-1,说明正反应活化能比逆反应活化能大100kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | n:(n+1) | C. | 1:(n+1) | D. | (n+1):n |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 试剂 | 现象 | |
| 滴管 | 试管 | ||
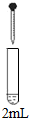 | 0.2 mol•L-1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
| 0.2 mol•L-1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
| 0.1 mol•L-1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||

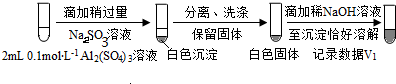
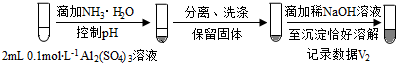 (按图形式呈现).
(按图形式呈现).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42- | |
| B. | 加入过量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- | |
| C. | 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- | |
| D. | 加入过量NaClO溶液和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com