
| A. | 0.1克 | B. | 0.2克 | C. | 0.3克 | D. | 0.4克 |
分析 金属Mg、Al与氯气反应生成氯化镁和氯化铝,固体质量增加的为Cl元素的质量,根据电子守恒可计算出Mg、Al在反应中失去电子的物质的量;等量的混合金属与盐酸反应时生成氯化镁、氯化铝,失去电子的物质的量与混合物与氯气反应转移电子相等,据此结合电子守恒可计算出生成氢气的物质的量,最后根据m=nM计算出生成氢气的质量.
解答 解:一定质量的Mg、Al的混合物放入足量的氯气中充分燃烧生成氯化镁、氯化铝,固体质量增加7.1g,增加的质量为Cl元素的质量,则产物中氯离子的物质的量为:$\frac{7.1g}{35.5g/mol}$=0.2mol,根据电子守恒可知反应中金属失去电子的物质的量为:0.2mol×1=0.2mol,
取等质量的混合物与足量盐酸反应,反应产物为氯化镁、氯化铝,金属失去电子的物质的量一定为0.2mol,根据电子守恒可知生成氢气的物质的量为:$\frac{0.2mol}{2}$=0.1mol,生成氢气的质量为:2g/mol×0.1mol=0.2g,
故选B.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握电子守恒在 化学计算中的应用方法,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 含有NA个原子的氢气在标准状况下的体积约为22.4 L | |
| B. | 25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA | |
| C. | 常温常压下,32gO2和32g O3所含氧原子数分别是2NA和3NA | |
| D. | Na2O2与CO2反应每生成1mol O2时所转移的电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
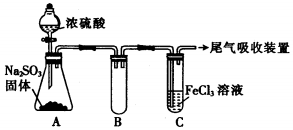
| 实验步骤(简述操作过程) | 预期现象和结论 |
| ① ② ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:丁>丙>乙>甲 | |
| B. | 乙元素在周期表中的位置为第三周期第Ⅳ族 | |
| C. | 1molA与足量B完全反应共转移1mol电子 | |
| D. | 1.0mol•L-1E溶液中阴离子总的物质的量小于0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿主要成分是 Fe2O3,Fe2O3是红棕色的,常用作红色油漆和涂料 | |
| B. | Fe3O4是黑色晶体,其中$\frac{1}{3}$的铁显+2 价,$\frac{2}{3}$的铁显+3 价 | |
| C. | FeO、Fe2O3 都不溶于水,但都能和盐酸反应生成相应的盐 | |
| D. | FeO 不稳定,在空气中加热迅速被氧化成 Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com